
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярность ковалентных связей. Электроотрицательность элементов
|
|
|
|
Чисто ковалентные связи образуются между атомами одного и того же элемента, например, чисто ковалентной является связь хлор—хлор в молекуле Сl2. В таких молекулах распределение электронной плотности абсолютно симметрично внутри связывающей молекулярной орбитали, а максимум электронной плотности приходится на середину расстояния между ядрами. По-иному распределяется электронная плотность в ковалентных связях между атомами элементов, имеющих различную электроотрицательность.
Ядро атома более электроотрицательного элемента притягивает электрон сильнее, чем ядро атома менее электроотрицательного элемента, что может быть следствием как различия зарядов ядер атомов этих элементов, так в различия в размерах и степени заполнения электронной оболочки атомов. По этой причине распределение электронной плотности вдоль связи асимметрично, а следовательно, атом более электроотрицательного элемента приобретает отрицательный эффективный заряд (обозначение d -), а атом-партнер — положительный эффективный заряд (обозначение d +). Численно эффективные заряды, реально существующие на связанных атомах, всегда меньше, чем их степени окисления.
П р и м е р: В молекуле НС1 распределение электронной плотности вдоль связи Н—С1 таково, что электрический «центр тяжести» отрицательного заряда смещен к атому С1, а «центр тяжести» положительного заряда — к атому Н. В результате на атомах хлора и водорода возникают эффективные заряды Нd+—С1d-, а связь водород—хлор приобретает частично ионный характер. В ковалентной молекуле НС1 ионный характер связи составляет 17 %, или полярность связи равна 17 %.
Ковалентные связи между атомами, несущими некоторый эффективный заряд, называются полярными ковалентными связями. Полярность присуща большинству ковалентных связей; степень разделения зарядов вдоль связи может быть различной — от ½ d ½ = 0 для чисто ковалентной связи до | d | = 1 для чисто ионной связи. Полярная ковалентная связь — это ковалентная связь с частичным характером ионной связи.
Атомы, которые образуют полярную ковалентную связь, имеют признак ионов — электрический заряд. Им свойственна также другая важная характеристика ионов — относительная подвижность. Молекулы соединений с полярными связями водород — элемент часто склонны к электролитической диссоциации в растворе, такие вещества называют потенциальными электролитами.
Переход от ионной к чисто ковалентной связи можно проследить на следующих соединениях хлора с элементами третьего периода Периодической системы CЛ. 20:
NаС1 МgС12 А1С13 SiСl4 РС!3 SС12 Сl2
чисто полярные ковалентные связи чисто
ионная ковалентная
связь связь
¬-------------------------------------
увеличение полярности связи
Полярность ковалентной связи можно оценить по шкале электроотрицательности, предложенной и обоснованной американским химиком Полингом в 1930г.
Электроотрицательность элемента (c) — это мера притяжения электронов, которое проявляет атом данного элемента, участвующий в ковалентной связи.
Разность значений электроотрицательности элементов, атомы которых образуют ковалёнтную связь, есть мера полярности химической связи.
Каждой ковалентной связи отвечает определенная разность значений c СЛ. 21:
| HF | cF=4,0 | cH=2,1 | Dc=1,9 |
| H2O | cO=3,5 | cH=2,1 | Dc=1,4 |
| NF3 | c=F4,0 | cN=3,0 | Dc=1,0 |
| HCl | cCl=3,0 | cH=2,1 | Dc=0,9 |
| NH3 | cN=3,0 | cH=2,1 | Dc=0,9 |
| ClO2 | cO=3,5 | cCl=3,0 | Dc=0,5 |
| Cl3N | cN=3,0 | cCl=3,0 | Dc=0 |
| Cl2 | cCl=3,0 | cCl=3,0 | Dc=0 |
В этих примерах полярность связей уменьшается, наиболее полярна гетероатомная связь Нd+— Fd-, наименее полярна гетероатомная связь Cld+—Nd-, чисто ковалентная связь С1 — С1 неполярна.
Чем больше значение разности Dc, тем сильнее ионный характер связи. По мере увеличения Dc максимум электронной плотности внутри связывающей молекулярной орбитали все более сдвигается к атомному ядру более электроотрицательного элемента. В предельном модельном случае (чистая абстракция, так как не существует элемент с c = 0) связывающие электроны полностью переходят на электронную оболочку атома более электроотрицательного элемента и возникает чисто ионная связь.
Все двухатомные двухэлементные молекулы Аd+—Вd- всегда оказываются полярными, поскольку химическая связь в них ковалентная полярная. Однако многоатомные двух- и многоэлементные молекулы могут быть и полярными, и неполярными, так как полярность всей молекулы зависит не только от наличия в ней полярных связей, но и от геометрической формы молекул. Электрические «центры тяжести» отрицательного и положительного зарядов чаще всего несовпадают из-за различного пространственного расположения осей гибридных орбиталей центрального атома. В таких молекулах образуется электрический диполь, который представляет собой систему из разнесенных в пространстве на некоторое расстояние зарядов, небольших по числу и различных по знаку.
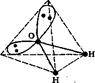
Молекулы, представляющие собой электрические диполи, называются полярными. Полярной является молекула воды Н2О; каждая связь в этой молекуле полярна (Нd+—Оd-). Геометрия молекулы отвечает дважды незавершенному тетраэдру рис.16 СЛ 22.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1151; Нарушение авторских прав?; Мы поможем в написании вашей работы!