
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородная связь (самостоятельно)
|
|
|
|
Рис. 6.4. Образование в молекуле бензола двухцентовых s-связей (а) и многоцентровых p-связей (б)
А Б
Рис. 6.1
Рис. 6.0
КОВАЛЕНТНЫЕ СВЯЗИ С УЧАСТИЕМ АТОМА УГЛЕРОДА (самостоятельно)
Существование большого числа органических соединений в значительной степени обусловлено двумя особыми свойствами атома углерода. Каждый атом углерода может образовывать четыре ковалентных связи и принимать участие в формировании четырех общих электронных пар. Кроме того, атом углерода имеет склонность (более всех других элементов) образовывать гомоядерные связи, давая так называемые углеродные цепи.
В основном состоянии атом углерода С(2s22р2) имеет два неспаренных электрона, за счет которых может образовывать только две общие электронные пары. Чтобы иметь возможность принять участие в образовании четырех общих электронных пар, атом углерода должен располагать четырьмя неспаренными электронами. Это достигается переходом атома углерода в возбужденное состояние (С*) при переносе одного 2s-электрона на 2р-подуровень рис 6.0.
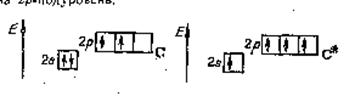
|
|
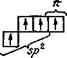
В возбужденное состояние атом углерода переходит при подводе энергии, называемой энергией возбуждения (эта затрата окупается затем энергией образования связей). После возбуждения 2s- и 2р-АО углерода гибридизуются тремя различными способами: sр3-гибридизация (тетраэдрическое расположение осей четырех гибридных АО); sр2-гибридизация (тригональное расположение осей трех гибридных АО); sp-гибридизация (линейное расположение осей двух гиб ридных АО) рис. 6.1.

|
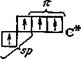
При sр2- и sp-гибридизации только три или две АО углерода участвуют в образовании s -связей. Оставшиеся АО углерода (и электроны в них) имеют возможность формировать p -составляющие многократных связей углерод—углерод.
Правильность этой модели образования четырех ковалентных связей подтверждается не только составом и геометрической формой молекул соединений углерода, но и четырехвалентным состоянием атома углерода в образуемых импростых веществах.
 Рис. 6.2
Рис. 6.2
П р и м е р ы:
1. В молекуле метанаСН4 атом углерода (sp3-ги6ридиэация) находится в тетраэдрическом окружении четырех атомов водорода (рис. 6.2а); в ней формируются четыре s -связи углерод — водород. Метан — это простейшее из органических соединений углерода, он не содержит связей углерод—углерод.
2. В молекуле этана С2Н8 атом углерода (sр3-гибридизация) так же, как и в молекуле метана СН4, находится в тетраэдрическом окружении, но образует два химически разных вида связей — три s -связи С—Н и одну s -связь С—С (рис. 6.2б).
3. В молекуле этилена С2Н4 атом углерода (sр2-гибридизация) находится в тригональном (треугольном) окружении, и образует две s -связи С—Н и одну s, p -связь С=С (рис. 6.3а). Разделение двойной связи на s - и p -составляющие условно, хотя вклад s -составляющей в общую энергию двойной связи (см. ниже) считается более высоким, чем вклад p -составляющей.
4. В молекуле ацетилена С2Н2 атом углерода (sp-гибридизация) находится в линейном окружении и образует одну s -связь С — Н и одну s, p, p -связь С ºС (рис. 6.3б).
Энергия одинарной, двойной и тройной связей углерод — углерод в органических соединениях имеет значения 346, 602 и 835 кДж/моль соответственно,

Рис. 6.3 Образование двойной связи углерод – углерод в молекуле этилена А; Образование тройной связи углерод — углерод в молекуле ацетилена Б.
Для органических соединений, которые обладают только одинарными s --связями углерод—углерод, например метана и этана, характерны реакции замещения. К реакциям присоединения без разрыва связи С—С (в этане и других гомологах метана) такие вещества не способны.
Для органических соединений, которые содержат двойные (s -, p -) и тройные (s-, p, p -) связи углерод—углерод, например этилена и ацетилена, характерны реакции присоединени я по месту разрыва p -составляющих кратных связей (s -составляющая как более устойчивая, три этом сохраняется. Реакции замещения для этих веществ также возможны.
В органических соединениях углерод может находится также в особом состоянии, называемом ароматическим состоянием. Это совершенно особый вид связывания атомов углерода в плоские циклы (замкнутые цепи), в которых все атомы цикла участвуют в образовании единой p -электронной системы.
Простейшее ароматическое соединение — бензол содержит шесть атомов углерода, связанных друг с другом в цикл (бензольное кольцо). Каждый атом углерода находится в в sp2-гибридизации, поскольку имеет три связанных с ним партнера — атом Н и два других атома С, образуются три s- связи — одна С—Н и две С—С. У каждого атома углерода в sр2-гибридизации имеется еще одна, негибридная 2р-орбиталь с неспаренным электроном, которая может образовать p -связь. Ось такой p-орбитали расположена перпендикулярно плоскости осей орбиталей, формирующих s -связи. В отличие от молекулы этилена, при образовании которой p -связи формируются между двумя атомами углерода, в молекуле бензола все шесть 2р-орбиталей комбинируются вместе, образуя общую для них связывающую молекулярную p -орбиталь, а шесть электронов объединяются в p -электронный секстет. Граничная поверхность такой орбитали (поровну над и под плоскостью s -связей) показана на рис. 6.4.
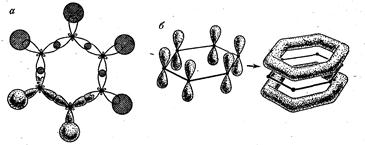
Метод молекулярных орбиталей всегда рассматривает образование связей как обобществление электронов в объеме пространства, включающем все ядра атомов данной молекулы. Особенно это верно для образования многоцентровых p -связей. В молекуле бензола образуется шестичленная молекулярная p -система, определяющая свойства всех ароматических соединений.
Плотность p -электронов молекулы С6Н6 делокализована по всем шести ядрам атомов углерода, т. е. по всей молекуле. Образование многоцентровых МО также особенно выгодно в энергетическом отношении, что придает устойчивость всей системе.
Для бензольного кольца характерны реакции замещения. При этом ароматическая система остается неизменной. В реакциях присоединения p -электронный секстет разрушается, из-за чего каждый электрон становится способным к образованию дополнительной s -связи, что выше уже отмечалось для этилена и ацетилена.
Атомы водорода, которые ковалентно связаны с атомом элемента, имеющего.высокую электроотрицательность (чаще всего F, О, М, а также Сl, S и С), несут на себе относительно высокий эффективный заряд. Вследствие этого такие атомы водорода могут электростатически взаимодействовать с атомами указанных элементов. Так, атом Нd+ одной молекулы воды ориентируется и соответственно взаимодействует (что показано тремя точками) с атомом О другой молекулы воды:
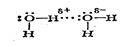
В твердой воде (лед) каждый атом О тетраэдрически окружен четырьмя атомами Н (два из них связаны ковалентно, два других — электростатически); получается соответствующая кристаллическая решетка льда. В жидкой воде практически отсутствуют свободные молекулы Н2О, которые за счет электростатического взаимодействия указанного типа объединяются в агрегаты (Н2О)n, при комнатной температуре среднее значение nравно 4. Этим объясняется меньшая летучесть воды (т. кип. +100<>С), чем у ее аналогов, в частности, у сероводорода Н2S (т. кип, -60 °С).
Связи, образуемые атомом Н, находящимся между двумя атомами электроотрицательных элементов, называются водородными.
Энергия ковалентной составляющей водородной связи А—Н имеет значение порядка 102 кДж/моль (F—Н 565, О—Н 459, N—Н 386 кДж/моль), а электростатическая составляющая — порядка 10 кДж/моль (т. е. она намного менее прочная). Однако силы Ван-дер-Ваальса значительно слабее (»1 кДж/моль), чем электростатическая составляющая водородной связи.
Пример: агрегации молекул за счет водородных связей образование зигзагообразных цепей в жидком фтороводороде НF:

Электростатическая модель образования водородных связей верна только в первом приближение, поскольку энергетически дополнительное связывание атома водорода должно иметь химическую природу. Метод валентных связей не может объяснить образование дополнительной связи атома Н, так как атом водорода одновалентен. Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования во-дородной связи. При сближении атома Н, ковалентно связанного с атомом электроотрицательного элемента А—Н, е другим атомом также электроотрицательного элемента Вd- возникает трехцентовая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома Вd- более выгодно, чем на атомной орбитали этого же атома.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 528; Нарушение авторских прав?; Мы поможем в написании вашей работы!