
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионизация слабых электролитов
|
|
|
|
Слабые электролиты образуют ионы обратимо в соответствии с законом действующих масс. Равновесие распада частицы на два иона подчиняется закону разведения Оствальда (следствие ЗДМ), устанавливающего зависимость между константой диссоциации и степенью диссоциации.
Пусть в растворе устанавливается равновесие
 KA K+ + A–
KA K+ + A–
В состоянии равновесия имеются равные концентрации катионов и анионов, которые можно выразить через степень диссоциации и общую концентрацию. Концентрация не диссоциированного вещества равна разности между общей концентрацией и концентрацией диссоциированного вещества:
 KA K+ + A–
KA K+ + A–
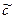 , моль/л c–α c α c α c
, моль/л c–α c α c α c
Применяем ЗДМ:
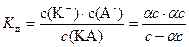 ,
,
где K д – константа диссоциации.
Окончательно получаем:
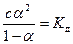
Это уравнение выражает закон разведения Оствальда. Оно применимо к разным обратимым процессам распада исходной частицы на две частицы. Чаще всего это слабые кислоты и основания. Некоторые комплексные соединения (Са2+-этилендиаминтетраацетат) также распадаются на центральный атом и один сложный лиганд. Уравнение закона Оствальда позволяет вычислять степень диссоциации при известной константе диссоциации и концентрации вещества.
При степени диссоциации α < 0,1 знаменатель принято считать равным единице, и расчеты проводят по приближенной формуле
 или
или 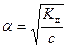
Пример. Рассчитайте степень диссоциации муравьиной кислоты в растворе с концентрацией 0,03 моль/л. K д(HCOOH) = 1,79·10–4. Рассчитайте также концентрации ионов.
Решение. Кислота диссоциирует по уравнению
 HCOOH HCOO– + H+
HCOOH HCOO– + H+
Для сравнения результатов проведем расчет по основной и приближенной формулам.
а)  ; α = 0,0744 (7,44%)
; α = 0,0744 (7,44%)
б) 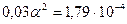 ; α = 0,0772 (7,72%)
; α = 0,0772 (7,72%)
Расхождение между результатами вычисления 0,3%. В подобных расчетах такая точность достаточна.
Вычислим концентрации ионов:
c (H+) = c (OH–) = α c = 0,03·0,0744 = 2,2·10–3 моль/л.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 619; Нарушение авторских прав?; Мы поможем в написании вашей работы!