
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы сильных электролитов. В растворах сильных электролитов межионное взаимодействие является главной причиной кажущегося уменьшения концентрации ионов
|
|
|
|
В растворах сильных электролитов межионное взаимодействие является главной причиной кажущегося уменьшения концентрации ионов. В учебнике изложены механизмы взаимодействия на молекулярном уровне. В лекции мы рассмотрим практические подходы к учету реального поведения сильных электролитов в растворах.
Есть аналитическая (обычная) концентрация электролита, которую вычисляют исходя из состава раствора и его плотности. В физико-химических свойствах раствора проявляется кажущаяся или эффективная концентрация, называемая активностью a. Математически она выражается следующим образом:
a = f · c
где f – коэффициент активности, c – аналитическая концентрация. По мере разбавления раствора значение f приближается к единице, а активность a – к концентрации c.
Основная задача теории сильных электролитов заключается в вычислении или экспериментальном определении коэффициентов активности разных электролитов. По теории Дебая-Хюккеля для очень разбавленных водных растворов коэффициент активности иона вычисляется по формуле
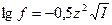 ,
,
где z – заряд иона, I – так называемая ионная сила раствора, определяемая как половина суммы произведений концентраций ионов на квадраты их зарядов:
000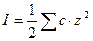
Раствор может содержать несколько веществ электролитов. Суммирование должно производиться по всем имеющимся ионам.
Пример. Рассчитайте ионную силу растворов CaCl2 (c = 0,0033 моль/л) и NaCl (c = 0,1 моль/л).
Решение. Без комментариев подставим числовые значения в формулы:
I (CaCl2) = 0,5(0,0033·22 + 0,0066·12) = 0,01
I (NaCl) = 0,5(0,01·12 + 0,01·12) = 0,01
Обратите внимание, что в случае электролита с однозарядными ионами ионная сила совпадает с концентрацией. В случае электролита с двухзарядным ионом то же значение I достигается при втрое меньшей концентрации. Если бы данные электролиты одновременно содержались в растворе, то ионная сила составила бы 0,02. Если же смешать эти растворы, то ионная сила остается без изменения.
Практически, коэффициенты активности редко вычисляют по формуле Дебая-Хюккеля. Их находят по таблицам для конкретного иона в зависимости от ионной силы раствора.
Пример. Вычислите активности ионов в растворе CaCl2 (c = 0,0033 моль/л).
Решение. Ионная сила раствора вычислена выше. Коэффициенты активности находим в таблице и вычисляем активности:
a (Ca2+) = 0,68·0,0033 = 0,00226 моль/л
a (Cl–) = 0,90·0,0066 = 0,006 моль/л
6. Коллигативные свойства растворов электролитов.
В растворах электролитов содержится большее число кинетически независимых частиц по отношению к не электролиту с той же молярной концентрацией. Следствие этого было обнаружено Вант-Гоффом. Осмотическое давление, 000, 000 имеют значения, в 2 и более раз превышающие те, которые вычисляются по формулам законов Вант-Гоффа и Рауля. В обычные формулы, определяющие коллигативные свойства, Вант-Гофф ввел так называемый изотонический коэффициент:
Δ T з(электролит)= i · K · b;
Δ T к(электролит)= i · E · b;
π(электролит)= i · c · R · T
Изотонический коэффициент показывает, во сколько раз действительное число кинетически независимых частиц в единице объема превышает число молекул в растворе не электролита с той же концентрацией растворенного вещества. Предельное значение изотонического коэффициента равно целому числу, совпадающему с числом ионов, на которые распадается структурная единица электролита. Так, у хлорида натрия i пред = 2; у хлорида кальция CaCl2 i пред = 3; у хлорида алюминия AlCl3 i пред = 4. В растворах с достаточно высокой концентрацией изотонический коэффициент существенно меньше ожидаемого целого числа вследствие понижения активности ионов.
Пример. Вычислите изотонический коэффициент хлорида кальция при концентрации раствора 0,0033 моль/л.
Решение. В разобранном выше примере были определены активности ионов:
a (Ca2+) = 0,00226 моль/л; a (Cl–) = 0,006 моль/л
Суммарная активность ионов составляет:
a (сумма) = 0,00226 + 0,006 = 0,00826 моль/л
Делим активность ионов на концентрацию соли, что и дает изотонический коэффициент:
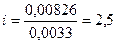 .
.
Электролиты являются необходимой составляющей плазмы крови, создающей осмотическое давление, соответствующее норме. Среди электролитов в организме человека в наибольшем количестве присутствует хлорид натрия. На его долю приходится около 93% осмотического давления плазмы. Внутривенно можно вводить только растворы, изотоничные плазме крови. Простейшим из таких растворов является физиологический раствор хлорида натрия с массовой долей NaCl 0,9% (ρ = 1,0047 г/мл). Его молярная концентрация 154,7 ммоль/л. Применяются и более сложные рецептуры заменяющих плазму растворов, приближенные к минеральному составу плазмы. Например, в состав 1 л раствора «Лактасоль» входит 6,2 г NaCl, 0,3 г KCl, 0,16 г CaCl2, 0,1 г MgCl2 и 3,36 г Na(CH3CH(OH)COO) (лактат натрия).
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 681; Нарушение авторских прав?; Мы поможем в написании вашей работы!