
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 12. Стандартная теплота реакции DrН°, – это теплота одного оборота реакции при определенных условиях
|
|
|
|
Стандартная теплота реакции DrН°, – это теплота одного оборота реакции при определенных условиях. В таблицах обычно даются значения для Т = 298,15 К (25°С).
(Оборот реакции – превращение, в котором количества участвующих веществ равны стехиометрическим коэффициентам; удобное, но редко используемое понятие).
Теплота реакции зависит от состояния веществ, поэтому состояние требуется указывать для каждого вещества в скобках после формулы, например
СаО (кр) + СО2 (г) = СаСО3 (кр), Dr Н ° = = -177 кДж
Это так называемое термохимическое уравнение.
Теплоты реакций определяют экспериментально в особых приборах, называемых калориметрами. Особенно подходящими для такого экспериментального изучения являются реакции сгорания (вещество + кислород), а также многие реакции в растворах. Есть и такие реакции, теплоту которых экспериментально определить затруднительно или невозможно. Для таких реакций теплота получается расчетным путем на основе закона Гесса (1840 г, Петербург), являющегося следствием первого начала термодинамики.
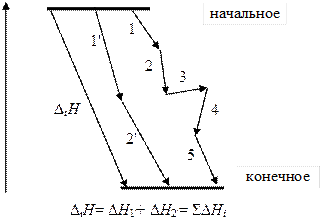
Теплота химической реакции равна сумме теплот любого ряда последовательных реакций с теми же исходными веществами и конечными продуктами.
Закон строго выполняется при проведении реакции или при постоянном объеме, или при постоянном давлении.
Закон Гесса это следствие первого начала термодинамики. Сущность его состоит в том, что теплота реакции зависит только от начального и конечного состоянием системы, и не зависит от пути процесса. Невозможно изменить теплоту реакции (например, получить дополнительную теплоту) изменением промежуточных стадий реакции.
Перекись водорода невозможно получить непосредственно из простых веществ; поэтому нельзя определить и теплоту реакции образования Н2О2. Но определена теплота ее разложения, а также теплота образования воды. По закону Гесса рассчитывается теплота образования Н2О2.
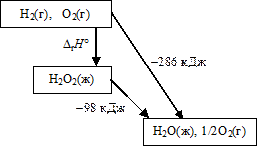
DrH° + (-98 кДж) = -286 кДж, DrH° = -188 кДж.
Этот же расчет можно провести в виде сложения (вычитания) уравнений реакций так, чтобы получить желаемое окончательное уравнение реакции:
 Н2 + ½О2 = Н2О; DrH° = -286 кДж
Н2 + ½О2 = Н2О; DrH° = -286 кДж
х (-1) Н2О2 = Н2О + ½О2; DrH° = -98 кДж)
 Н2 + О2 = Н2О2; DrH° = -188 кДж
Н2 + О2 = Н2О2; DrH° = -188 кДж
Теплота любой химической реакции может быть рассчитана на основе закона Гесса с применением табличных данных по стандартным теплотам образования и стандартным теплотам сгорания веществ, фигурирующих в уравнении реакции. (По казать в Практикуме таблицу на с. 221)
Стандартная теплота образования Df H °, кДж/моль, численно равна изменению энтальпии при образовании 1 моль сложного вещества из простых веществ. Дополнительные условия: состояние простых веществ.
Стандартная теплота сгорания Dс H °, кДж/моль, численно равна изменению энтальпии при сгорании 1 моль вещества в кислороде. Дополнительные условия: образование высших оксидов, кроме азота.
При наличии необходимых табличных данных, теплоты реакций вычисляется по формулам
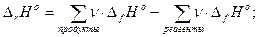

Доказать эти уравнения можно на основе схем типа

Аналогично и для второго уравнения.

Пример. Рассчитайте стандартную теплоту реакции
2H2S(г) + 6NO(г) = 2H2O(ж) + 2SO2(г) + 3N2(г).
(записываем под формулами веществ значения Df H ° из таблицы)
| Df H °, кДж/моль | -20,5 | гш90 | -286 | -297 |
Вычислим Dr H °:
Dr H ° = [2(-286) + 2(-297)] - [2(-20,5) + 6×90] = -1665 кДж/моль.
Гетерогенные равновесия и процессы в жизнедеятельности
Наша сегодняшняя тема связана с хорошо знакомыми вам реакциями осаждения. Теперь их предстоит рассмотреть количественно.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 532; Нарушение авторских прав?; Мы поможем в написании вашей работы!