
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биогенные элементы
|
|
|
|
Константа равновесия суммарной реакции меньше единицы. В стандартном состоянии иод окисляет ионы железа. Но, как следует из значений потенциалов, при отсутствии совмещения с гетерогенной реакцией, ионы Fe3+ окисляют ионы иода. Вследствие малой растворимости соли PbI2, в растворе поддерживается низкая концентрация I–, чем и объясняется направление реакции.
Совмещение гетерогенного и лигандообменного процессов. Выше уже рассматривался пример реакции оксалата кальция с комплексоном.

 CaC2O4 + ЭДТА4- = [CaЭДТА]2- + C2O42-
CaC2O4 + ЭДТА4- = [CaЭДТА]2- + C2O42-
K s = 2,3×10–9 b =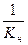 =
= 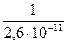 = 3,9×1010
= 3,9×1010

 C2O42- + Са2+ + ЭДТА4-
C2O42- + Са2+ + ЭДТА4-
K Σ = 2,3×10–9·3,9×1010 = 89,7;
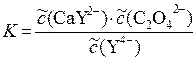
Из значения константы следует, что реакция идет в прямом направлении до тех пор, пока произведение концентраций справа превышает концентрацию иона комплексона слева не более чем в ~90 раз.
Проведенный расчет равновесия с участием комплексона справедлив для случая, когда концентрация ионов водорода достаточно мала (рН ~11), и этилендиаминтатрауксусная кислота полностью переходит в ионы ЭДТА4– (Y4–). При понижении рН ионы Y4– протонируются, и в процессе комплексообразования с кальцием идет замещение Н+ на Са2+. Если рН среды понижается до 8, то в растворе преобладают ионы комплексона Н2ЭДТА2–. Реакция с ионом кальция пойдет следующим образом:
Са2+ + Н2ЭДТА2– = [СаЭДТА]2– + 2Н+
Не проводя детального анализа процесса, применим упомянутое выше правило:
Общая константа совмещенного равновесия равна отношению произведений констант диссоциативного типа (K s, K a, K н) веществ слева в уравнении реакции к произведению таких же констант веществ справа. Или: произведению констант диссоциативного типа веществ слева и констант ассоциативного типа веществ справа.
Константы кислотности иона Н2ЭДТА2– следующие: K а3 = 6,9×10-7; K а4 =5,5×10-11
(здесь взяты константы с индексами 3 и 4, так как первые две константы кислотности соответствовали бы молекуле Н4ЭДТА и иону Н3ЭДТА–).
Вычисляем константу совмещенного равновесия:
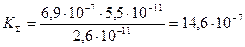
Из результата расчета следует, что в недостаточно щелочной среде, и тем более в нейтральной и кислой среде, комплексообразование кальция с комплексонами типа ЭДТА становится невозможным. По этой причине в лабораторной работе вы проводили реакцию с комплексоном в среде аммиачно-аммонийного буферного раствора.
В сложном процессе может быть совмещено и более двух равновесий разного типа. В качестве еще одного примера, видоизменим предыдущую реакцию, взяв ионы кальция в составе нерастворимой соли оксалата кальция. Возникают концурирующие процессы гетерогенный – лигандообменный – протолитический:

 СаС2О4 + Н2ЭДТА2– = [СаЭДТА]2– + H2С2О4
СаС2О4 + Н2ЭДТА2– = [СаЭДТА]2– + H2С2О4



 С2О42– + Са2+ + ЭДТА4– + 2Н+
С2О42– + Са2+ + ЭДТА4– + 2Н+
 |
При вычислении константы равновесия суммарного процесса придется учитывать константу растворимости оксалата кальция и константы кислотности щавелевой кислоты. Это не так уж сложно сделать, руководствуясь правилом (см. выше), и найдя предварительно в справочнике необходимые константы отдельных равновесий.
Три вида равновесий, совмещенных в этом примере, играют роль в биохимических процессах. Например, разрушение минеральной основы костей может происходить как вследствие связывания ионов кальция с появившимся в результате патологии избытком веществ-лигандов, так и в результате избыточного протонирования ионов фосфорной кислоты при ацидозе. Тогда равновесие между фосфатами смещается в направлении образования ионов Н2РО4–, образующих с ионом Са2+ достаточно хорошо растворимую соль.
Так можно рассчитывать константы равновесия сложных процессов, прогнозировать их направление, и выбирать условия, способствующие смещению равновесия в желаемом направлении.
Новый семестр мы начнем с изучения нового раздела нашего курса – это бионеорганическая химия. От рассмотрения законов химии, действующих также и в живых организмах, перейдем к химическим элементам, являющимся, материальными составляющими жизни.
Надежно известная и хорошо изученная к настоящему времени материя строится на фундаменте из трех видов относительно устойчивых частиц – протонов, нейтронов и электронов. Силы взаимодействия между этими частицами обусловливают образование из них частиц следующего уровня структурирования – атомов. В ядрах атомов силы притяжения между протонами и нейтронами столь велики, что эти частицы сохраняются неизменными вплоть до температур в миллионы градусов. При высоких температурах (до 107 К) атомы могут терять все свои электроны, но ядра остаются неизменными. Это и позволяет говорить, что в природе существуют устойчивые атомы. Каждый атом характеризуется зарядом ядра и массой.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 782; Нарушение авторских прав?; Мы поможем в написании вашей работы!