
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектральные закономерности
Ядерная модель атома. Постулаты Бора.
Лекция 3.12
Изучение спектров излучения сыграло большую роль в познании строения атомов. В первую очередь это касается спектров, обусловленных излучением невзаимодействующих друг с другом атомов. Эти спектры состоят из отдельных узких спектральных линий, и их называют линейчатыми.
Наличие многих спектральных линий указывает на сложность внутреннего строения атома. Изучение атомных спектров послужило ключом к познанию внутренней структуры атомов. Прежде всего, было замечено, что спектральные линии расположены не беспорядочно, а образуют серии линий. Изучая линейчатый спектр атомарного водорода, Бальмер (1885) установил некоторую закономерность. Для части линий соответствующие им частоты можно в современных обозначениях представить так:
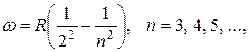 (3.12.1)
(3.12.1)
где w — циклическая частота, соответствующая каждой спектральной линии (w = 2 πc / l), R — постоянная, называемая постоянной Ридберга:
R = 2,07 × 1016 c-1. (3.12.2)
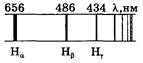 Формулу (3.12.1) называют формулой Бальмера, а соответствующую серию спектральных линий — серией Бальмера (рис.3.12.1). Основные линии этой серии находятся в видимой части спектра.
Формулу (3.12.1) называют формулой Бальмера, а соответствующую серию спектральных линий — серией Бальмера (рис.3.12.1). Основные линии этой серии находятся в видимой части спектра.
Дальнейшие исследования спектра атомарного водорода Рис.3.12.1.
показали, что имеется еще несколько серий.
В ультрафиолетовой части спектра — серия Лаймана:
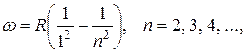 (3.12.3)
(3.12.3)
а в инфракрасной части спектра – серия Пашена:
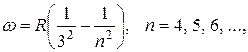 (3.12.4)
(3.12.4)
и так далее.
Все эти серии можно представить в виде обобщенной формулы Бальмера:
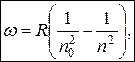 (3.12.5)
(3.12.5)
где 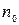 - постоянное для каждой серии число: n 0 = 1 для серии Лаймана, n 0 = 2 для серии Бальмера и т. д. При заданном n 0 число n принимает все целочисленные значения, начиная с n 0 + 1.
- постоянное для каждой серии число: n 0 = 1 для серии Лаймана, n 0 = 2 для серии Бальмера и т. д. При заданном n 0 число n принимает все целочисленные значения, начиная с n 0 + 1.
Максимальной длине волны серии Лаймана (3.12.3) отвечает n = 2, это l макс = 2 πс / w мин = 8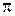 с /3 R = 121,6 нм. Соответствующую спектральную линию называют резонансной линией водорода.
с /3 R = 121,6 нм. Соответствующую спектральную линию называют резонансной линией водорода.
С ростом n частота линий в каждой серии стремится к предельному значению 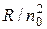 , которое называют границей серии (рис.3.12.1). За границей серии спектр не обрывается, а становится сплошным. Это присуще не только всем сериям водорода, но и атомам других элементов.
, которое называют границей серии (рис.3.12.1). За границей серии спектр не обрывается, а становится сплошным. Это присуще не только всем сериям водорода, но и атомам других элементов.
Таким образом, интересующая нас серия Бальмера заключена в спектральном интервале от 365 нм до 656 нм, т. е. действительно, все основные линии ее расположены в видимой области спектра.
Опыты Резерфорда. Ядерная модель атома.
Излучение электромагнитных волн возможно при ускоренном движении зарядов. Атом в целом электрически нейтрален. С другой стороны известно, что в состав атома входят отрицательно заряженные электроны. Следовательно, в его состав должны входить также положительно заряженные частицы.
Принятую в настоящее время модель атома предложил Резерфорд, базируясь на результатах своих опытов по рассеянию 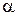 - частиц.
- частиц.
В этих опытах очень тонкая золотая фольга облучалась пучком 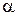 - частиц с довольно большой энергией.
- частиц с довольно большой энергией. 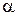 – частицами называют один из видов частиц, испускаемых некоторыми веществами при радиоактивном распаде. В то время уже были известны масса
– частицами называют один из видов частиц, испускаемых некоторыми веществами при радиоактивном распаде. В то время уже были известны масса 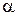 – частицы (
– частицы (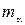 ) и ее положительный заряд, равный удвоенному элементарному заряду (модулю заряда электрона). Проходя сквозь фольгу,
) и ее положительный заряд, равный удвоенному элементарному заряду (модулю заряда электрона). Проходя сквозь фольгу, 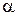 – частицы рассеивались атомами вещества, т.е. отклонялись на некоторый угол от первоначального направления. Регистрация рассеянных частиц осуществлялась по вспышкам света, возникающим при их ударе об экран, покрытый сернистым цинком.
– частицы рассеивались атомами вещества, т.е. отклонялись на некоторый угол от первоначального направления. Регистрация рассеянных частиц осуществлялась по вспышкам света, возникающим при их ударе об экран, покрытый сернистым цинком.
В результате опытов оказалось, что почти все 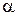 - частицы проходили сквозь фольгу, отклоняясь на очень небольшие углы. Однако, было небольшое количество
- частицы проходили сквозь фольгу, отклоняясь на очень небольшие углы. Однако, было небольшое количество 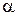 – частиц, которые отклонялись на очень большие углы (почти до 180
– частиц, которые отклонялись на очень большие углы (почти до 180 ). Проанализировав результаты опытов, Резерфорд пришел к выводу, что столь сильное отклонение
). Проанализировав результаты опытов, Резерфорд пришел к выводу, что столь сильное отклонение 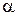 - частиц возможно при их взаимодействии с положительно заряженной частью атома, в которой сосредоточена его основная масса.
- частиц возможно при их взаимодействии с положительно заряженной частью атома, в которой сосредоточена его основная масса.
Размеры этой части можно оценить, если предположить, что 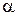 - частица, отбрасывается в обратном направлении после «упругого лобового столкновения» с положительно заряженной частью атома. Для этого нужно приравнять кинетическую энергию
- частица, отбрасывается в обратном направлении после «упругого лобового столкновения» с положительно заряженной частью атома. Для этого нужно приравнять кинетическую энергию 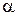 - частицы к потенциальной энергии ее взаимодействия с этой частью атома в момент остановки
- частицы к потенциальной энергии ее взаимодействия с этой частью атома в момент остановки 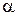 - частицы:
- частицы:
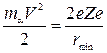 , (3.12.6)
, (3.12.6)
где V - скорость 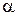 - частицы, 2е – ее заряд, Zе – заряд положительной части атома,
- частицы, 2е – ее заряд, Zе – заряд положительной части атома, 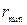 - минимальное расстояние, на которое
- минимальное расстояние, на которое 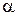 - частица сможет приблизиться к положительной части атома (в атомной физике принято использовать Гауссову систему единиц). Положив в этом равенстве Z = 79 (золото), V =10
- частица сможет приблизиться к положительной части атома (в атомной физике принято использовать Гауссову систему единиц). Положив в этом равенстве Z = 79 (золото), V =10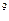
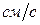 ,
, 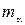 =4·1,66·10
=4·1,66·10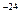 г = 6,6·10
г = 6,6·10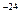 г, получим
г, получим
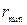 ≈ 10
≈ 10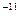 см.
см.
Напомним, что, изучая свойства газов с помощью методов кинетической теории, можно определить размеры атомов. Найденные таким способом размеры для всех атомов имеют порядок 10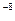 см. Таким образом, размер положительной части атома оказался на несколько порядков меньше размера атома.
см. Таким образом, размер положительной части атома оказался на несколько порядков меньше размера атома.
На основании этих оценок Резерфорд предложил ядерную (или планетарную) модель атома. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре, размер которого ≈ 10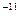 см, пренебрежимо мал по сравнению с размером атома. Вокруг ядра движутся электроны, занимая огромную по сравнению с ядром область с линейным размером порядка 10
см, пренебрежимо мал по сравнению с размером атома. Вокруг ядра движутся электроны, занимая огромную по сравнению с ядром область с линейным размером порядка 10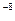 см.
см.
Однако, если принять эту модель, то становится непонятно, почему электроны не падают на ядро. Между электроном и ядром существует только кулоновская сила притяжения. Поэтому электрон не может покоиться. Он должен двигаться вокруг ядра. Но в этом случае, согласно законам классической физики, он должен излучать, причем на всех частотах, что противоречит опыту. Теряя энергию, электрон должен упасть на ядро (атом высветится). Оценки показали, что вся его энергия будет излучена за время порядка 10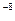 с. Это и будет «время жизни» атома.
с. Это и будет «время жизни» атома.
|
|
Дата добавления: 2013-12-13; Просмотров: 1428; Нарушение авторских прав?; Мы поможем в написании вашей работы!