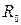КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия молекул. Энергетические зоны в кристаллах
|
|
|
|
Лекция 3.17
Энергия молекулы. Молекулярные спектры.
При образовании молекулы атомы утрачивают свою индивидуальность за счет формирования химических связей и их внешние электронные оболочки претерпевают сильные изменения. Электроны внутренних оболочек при объединении атомов в молекулу остаются в прежних состояниях. Для точного описания свойств молекулы ее удобнее рассматривать как систему из непрерывно колеблющихся ядер, а также электронов, которые быстро движутся вокруг ядер, создавая электронное облако. При этом оказывается, что молекулярные характеристики определяются потенциальной энергией U взаимодействия ядер и электронов (это взаимодействие заключается главным образом в кулоновском притяжении между ядрами и электронами и в отталкивании ядер и соответственно электронов друг от друга).
Для молекул каждого вещества существует такое расположении ядер атомов, при котором потенциальная энергия молекулы U минимальна. Это расположение соответствует равенству сил притяжения и отталкивания и называется равновесным. Однако ядра вследствие колебаний постоянно перемещаются около положений равновесия.
Кроме того, молекула может вращаться относительно ее центра масс.
Простейшей молекулой является молекула водорода, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами образуется ковалентная химическая связь, при которой электроны движутся около обоих ядер. Квантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Им удалось решить уравнение Шрёдингера для системы, состоящей из двух ядер и двух электронов. Получающиеся из этого уравнения собственные значения энергии оказываются зависящими от расстояния между ядрами R (рис.3.17.1), где пунктирной линией изображена энергия атома при параллельной ориентации спинов электронов, а сплошной – при антипараллельной ориентации. Образование молекулы возможно лишь при сближении атомов с антипараллельными спинами. Асимптотическое значение энергии, к которому стремится энергия молекулы при R→ 0 для обеих кривых одинаково и равно сумме энергий изолированных атомов.
|
 Аналогично обстоит дело и с другими двухатомными молекулами. Энергия, обусловленная электронной конфигурацией (электронная энергия), имеет минимум при некотором значении R
Аналогично обстоит дело и с другими двухатомными молекулами. Энергия, обусловленная электронной конфигурацией (электронная энергия), имеет минимум при некотором значении R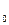 . Изменение электронной конфигурации приводит к изменению кривой зависимости электронной энергии от расстояния между ядрами атомов R.
. Изменение электронной конфигурации приводит к изменению кривой зависимости электронной энергии от расстояния между ядрами атомов R. 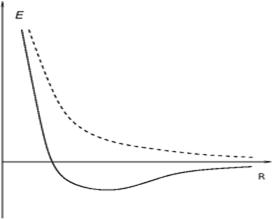
Рис.3.17.1.
Таким образом, движение системы происходит в потенциальной яме, а, следовательно, энергетический спектр дискретен.
В первом приближении отдельные виды молекулярных движений – движение электронов, колебания и вращение молекулы – можно считать независимыми друг от друга. Поэтому полную энергию молекулы можно представить в виде
 , (3.17.1)
, (3.17.1)
где  - Энергия, обусловленная электронной конфигурацией (электронная энергия),
- Энергия, обусловленная электронной конфигурацией (электронная энергия), 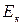 - энергия, соответствующая колебаниям молекулы (колебательная или вибрационная энергия),
- энергия, соответствующая колебаниям молекулы (колебательная или вибрационная энергия), 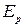 - Энергия, связанная с вращением молекулы (вращательная или ротационная энергия).
- Энергия, связанная с вращением молекулы (вращательная или ротационная энергия).
Малым параметром задачи является отношение массы электрона т к массе ядра М. Электронное слагаемое  не зависит от этого отношения, колебательное
не зависит от этого отношения, колебательное 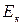 пропорционально
пропорционально 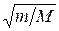 , вращательное
, вращательное 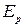 пропорционально m / M. Поэтому расстояние между вращательными уровнями значительно меньше расстояния между колебательными уровнями, которое в свою очередь значительно меньше расстояния между электронными уровнями
пропорционально m / M. Поэтому расстояние между вращательными уровнями значительно меньше расстояния между колебательными уровнями, которое в свою очередь значительно меньше расстояния между электронными уровнями 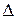
 »
» 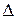
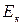 »
» 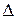
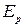 . Следовательно, схема энергетических уровней двухатомной молекулы выглядит так, как показано на рис.3.17.2, т.е. электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные.
. Следовательно, схема энергетических уровней двухатомной молекулы выглядит так, как показано на рис.3.17.2, т.е. электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные.
Таким образом, одному и тому же изменению электронного состояния соответствуют различные изменения колебательной и вращательной энергии. Поэтому при переходах между состояниями с различными энергиями на одно и то
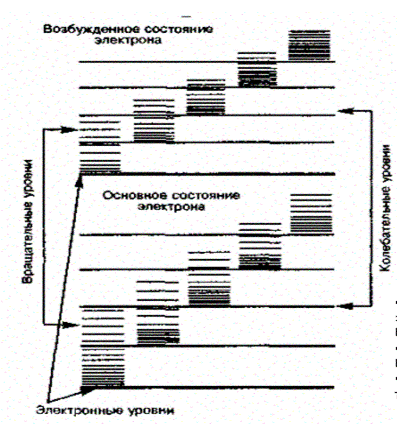
Рис.3.17.2.
же значение 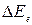 могут накладываться мало отличающиеся друг от друга
могут накладываться мало отличающиеся друг от друга 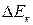 и
и 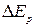 . Это приводит к излучению (или поглощению) фотонов мало отличающихся по частоте. Поэтому при наблюдении спектров излучения (или поглощения) с помощью приборов с небольшой разрешающей способностью эти спектры представляются состоящими из отдельных полос – полосатые спектры.
. Это приводит к излучению (или поглощению) фотонов мало отличающихся по частоте. Поэтому при наблюдении спектров излучения (или поглощения) с помощью приборов с небольшой разрешающей способностью эти спектры представляются состоящими из отдельных полос – полосатые спектры.
Энергетические зоны в кристаллах.
В настоящее время для объяснения электрических свойств кристаллов общепринята зонная теория твердого тела. Рассмотрим основные выводы этой теории.
В изолированном атоме электроны обладают некоторыми дискретными энергиями. При этом валентные электроны атома могут находиться либо в нормальном, либо в одном из возбужденных состояний. Иначе говоря, валентные электроны изолированного атома могут находиться на одном из энергетических уровней. Самый низкий из этих уровней будет соответствовать невозбужденному основному состоянию.
В кристалле вследствие наложения друг на друга многих атомных полей валентный электрон будет взаимодействовать не только со своим положительным ионом (ядро + остальные электроны), но также с ядрами и электронными оболочками других атомов, входящих в кристалл. Такое взаимодействие приводит к расщеплению резко ограниченных уровней в довольно широкую энергетическую полосу или зону, ширина которой оценивается величиной порядка нескольких электрон-вольт, а расстояние между соседними уровнями в зоне составляет ~ 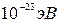 . Согласно принципу Паули в системе не может быть двух тождественных электронов. Поэтому каждым значением энергии может обладать только два электрона (с противоположными спинами). Это значит, что на каждом энергетическом уровне может находиться два электрона.
. Согласно принципу Паули в системе не может быть двух тождественных электронов. Поэтому каждым значением энергии может обладать только два электрона (с противоположными спинами). Это значит, что на каждом энергетическом уровне может находиться два электрона.
Возбужденные энергетические уровни также расщепляются на зоны. Ширина возбужденной зоны больше ширины невозбужденной зоны, но имеет тот же порядок (несколько электрон-вольт). Невозбужденную зону принято называть – валентной зоной, ближайшую к ней возбужденную зону - зоной проводимости. Обе эти разрешенные зоны разделяются запрещенной зоной. Энергия кристалла не может принимать значения, лежащие в этой зоне.Электрические и оптические свойства вещества определяются поведением валентных электронов. Энергетические диаграммы твердого тела по зонной теории изображены на рис.3.17.3.Электрические свойства кристаллов определяются структурой энергетических зон, то есть заполнением зон электронами и шириной запрещенной зоны.
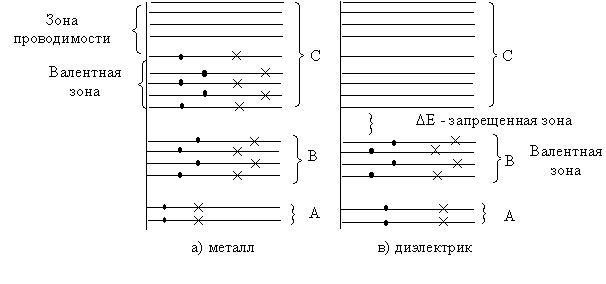
Рис.3.17.3
Для металлов (рис.3.17.3а) нижняя группа уровней А и В характеризует энергии электронов внутренних оболочек, тесно связанных в атомах. Верхняя зона С содержит энергетические уровни внешних валентных электронов и заполнена только частично. При приложении к металлу электрического поля валентные электроны, ускоряясь полем, могут приобретать небольшие порции энергии и переходить на более высокие уровни внутри зоны С. Таким образом, зону С можно разделить на две части: нижняя ее часть - валентная зона, верхняя - зона проводимости. Для металла эти две зоны непосредственно соприкасаются друг с другом, и электроны свободно переходят из валентной зоны в зону проводимости. Поэтому электроны могут ускоряться даже небольшим электрическим полем и приобретать дополнительную скорость в направлении против электрического поля – возникает электрический ток. Такие кристаллы будут обладать хорошей электропроводностью при любых температурах и независимо от ширины запрещенной зоны.
У диэлектриков (рис.3.17.3 в) все энергетические уровни валентной зоны полностью заполнены электронами (по два электрона на каждом уровне), а энергетические уровни зоны проводимости совершенно свободны (при абсолютном нуле температур). Зона проводимости С отделена от валентной зоны В широким интервалом (запрещенная зона). Ширина запрещенной зоны у диэлектриков велика (5÷ 10 эВ).
При любых температурах, отличных от абсолютного нуля, в зоне проводимости находится небольшое количество электронов, попадающих туда за счет флуктуаций тепловой энергии. Электроны, попадающие по своему энергетическому состоянию в зону проводимости, при наложении внешнего поля будут участвовать в упорядоченном движении (т.к. рядом имеются свободные энергетические уровни), то есть будут создавать электрический ток.
Поэтому возбужденная зона называется зоной проводимости. Эти электроны обуславливают некоторую проводимость диэлектриков, вследствие чего удельное сопротивление не бесконечно велико, а имеет конечное значение. При очень низких температурах зона проводимости у диэлектриков свободна от электронов, а большая ширина запрещенной зоны исключает возможность перехода электронов из валентной зоны в зону проводимости за счет энергии электрического поля. Дело в том, что электрон способен накапливать энергию от электрического поля только на пути свободного пробега, длина которого в реальных кристаллах очень мала (10-6 ÷ 10-7 см), поэтому даже в очень сильных полях порядка 105 В/см электрон не может получить энергию, достаточную для преодоления запрещенной зоны.
В полупроводнике распределение разрешенных и запрещенных зон подобно диэлектрику, но в полупроводнике ширина запрещенной зоны (величина 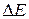 ) превышает среднюю энергию теплового движения всего лишь в несколько десятков раз (от долей электрон-вольта до 3 эВ), поэтому уже при комнатных температурах часть валентных электронов из зоны В может быть переброшена в зону С и полупроводник начинает проводить электрический ток - электронная проводимость. Отличие такого полупроводника от металла в том, что в металле концентрация свободных электронов постоянна и электрическое сопротивление с ростом температуры возрастает. В полупроводниках рост температуры сопровождается быстрым увеличением числа электронов в зоне проводимости и, следовательно, уменьшением электрического сопротивления.
) превышает среднюю энергию теплового движения всего лишь в несколько десятков раз (от долей электрон-вольта до 3 эВ), поэтому уже при комнатных температурах часть валентных электронов из зоны В может быть переброшена в зону С и полупроводник начинает проводить электрический ток - электронная проводимость. Отличие такого полупроводника от металла в том, что в металле концентрация свободных электронов постоянна и электрическое сопротивление с ростом температуры возрастает. В полупроводниках рост температуры сопровождается быстрым увеличением числа электронов в зоне проводимости и, следовательно, уменьшением электрического сопротивления.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 564; Нарушение авторских прав?; Мы поможем в написании вашей работы!