
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
О таблице Менделеева
|
|
|
|
Энергия ионизации атомов.
Характеристики атома.
1).Энергия, которую необходимо затратить, чтобы оторвать электрон от атома и переместить его на бесконечно далёкий от него уровень. Причём атом становится полностью заряженным.
Эта энергия называется потенциалом ионизации. Li: 5,39 Эл. Вольт.
Энергия отрыва одного электрона от атома Li –75,6 ЭВ, для второго атома Li – 122,4 ЭВ…
Потенциал ионизации изменяется скачком 1 .
.
Электронные оболочки имеют ступенчатые (слоистые) строения.
2). Энергия сродства к электрону – изменение энергии атома при его присоединении к нейтральному атому с образованием отрицательного иона при 01К.
А + е  А-.
А-.
Электрон занимает нижнюю орбиталь с соблюдением правила Гунда.
Наиболее высокие энергии сродства у галогенов. Сумма всех энергий ионизации = Е полная.
3). Универсальная характеристика, объединяющая 1,2 электроотрицательность.
- сумма энергии ионизации и энергии сродства. Чем больше электроотрицательность, тем легче атом превращается в заряженный ион.
Электроотрицательность: Li =1, Na =0.9, K = 0.8, Cs = 0.7, Be = 1.5, Mg = 1.2, B = 2, F = 4, p = 2.5.
Периодический закон Менделеева.
Формулировка Менделеева.
Свойства простых веществ, а также форма и свойства сложных элементов находятся в периодической зависимости от атомных весов этих элементов. Периодическая система – графическое отражение периодического закона.
8 групп главных
побочные – переходные элементы.
22 не Ме
11 не Ме – газы
полупроводники элементарные
В,С Р S
Si As 6гр Se
Ge Sb Te
Sn
Главный базовый полупроводник – Si(кремний)
А3В5 GaP InP
AlP Ga As InAs
AlAs GaSb Isb
AlSb
 |
AlN
CaN 6эВ AlxGa1-xAs – инфракрасное излучение.
InN
HgGaTe
PbTe
CuTe
CdTe
Современная трактовка таблицы:
Свойства элементов и мх соединений находятся в переодической зависимости от зарядов и ядер, атомов, элементов
Порядок заполнения электронных уровней и подуровней.
Правило Клечковского В.М.
Электрон заполн. Подуровень должен иметь минимально избыточной энергией по отношению к подуровню энергии.
Li 1822S1
Al18 1S22S22P63S23P63d0
K19 1S22S22P63S23P64S1
1. Правило Клечковского.
Заполнение идет от n+1 меньших к n+l больших
4S 3d
4+0 < 3+2 (сначала 4S, потом 3d)
2. Правило
Если суммы n+l равны друг другу, тозаполнение уровней и подуровней происходит в напр главного квантового числа k
4p 3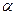
4+1 3+2 => сначала 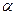 , потом 4p
, потом 4p
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 493; Нарушение авторских прав?; Мы поможем в написании вашей работы!