
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод валентных связей
|
|
|
|
Схема заполнения уровней и подуровней по Клечковскому.
Лекция №2
Правило Клечковского.
Если сумма n+l равных
 3d 4p 5S
3d 4p 5S
3+2 = 4+1 = 5+0

 4S
4S
Явление правила проскока электронов.
Cr24 1S2 2S2 2P6 3S2 3P6 4S2 3d4
 |
 |
Валентность как правило определяется S и P электронами (…..)
 1S2 2S2 2P6 3S2 3P6 4S2 3d10 4p6 – 5S2 – 4d10 - 5p6 –6S2 – 5d1 – 4f4 - 5d2-10 – 6p6 – 7s2 - 6d1 –5f14 - 6d2-10 – 7p6
1S2 2S2 2P6 3S2 3P6 4S2 3d10 4p6 – 5S2 – 4d10 - 5p6 –6S2 – 5d1 – 4f4 - 5d2-10 – 6p6 – 7s2 - 6d1 –5f14 - 6d2-10 – 7p6
Лантонойды и октенойды.
Химическая связь и строение малекул.
Химический процесс – процесс разрыва одних и образования других связей.
Характеристикой свойств хим. Связи определяется химическое взоимодействие, т.е. форму движения малекул.
Энергия молекул складывается из: движения электронов в поле ядер, колебания ядер около полжения равновесия, вращение молекул вокруг центра масс.

Основной вклад вносит движение электронов в поле ядер.
Теория хим. Связи строется на решении квантовой задачи движение электронов в поле ядер.
Несколько методов решения.
Решение: различная притяженность для разных вычислений.
|
Молекулярных орбиталей
МВС (1) Пологается что каждая молекула состоит из атомов и для обьяснения электоронного строения применены атомные орбитали состав. ее атома.
ММО(2) Рассматривается молекула как единое целое.
Эфективн.ММО
1. Химическая связь образуется парой электронов с противополжным спинами, которые локализованы между двумя атомами.
2. Число связей, образованным данным атомом равно числу неспаренных частиц (ЭЛ-В) в основном и неспаренном состоянии.
 |
3. Аддитивность ( ) энергии связи и других св-в является средством локализации пры электронов.
) энергии связи и других св-в является средством локализации пры электронов.
4.  св-во молекул опр.
св-во молекул опр.  св-ва связи.
св-ва связи.
5. Направленность валентности определяется ортогональностью орбиталей (расположенностью).
6. Валентно насыщеные молекулы могут образовывать соединения за счет донорного акценторного взоимодействия (наличее валент. Атомн. Орбитали и неподеленной пары электронов).
Направленность спинов:

 |
Энергия связи.
Под ней понимается та энергия, которая выделяется в результате взоимодействия данных атомов, участвующих в реакции.
Если соединение двух атомно;

m0-атомарная энергия обр. (тепловой эффект), есть енергия связи

 Пример:
Пример: 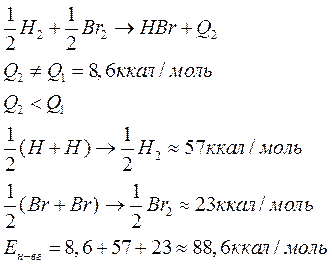
Метод молекулярных орбиталей:
Характеристики:
1. Молекула рассматривается как целое, а не как совокупность сохраняющих индивидуальность атомов (индивидуальные характеристики).
1.2 Каждый электрон принадлежит целой молекуле и движется в поле ядер.
2. Состояние электрона в молекуле описывается молекулярной орбиталью, которая характерна набором квантовых чисел
2.1 Молекулярная орбиталь многоцентр –я.
3.Каждой молекулярной орбитали соответствует своя энергия, которая  потенциалу ионизации данной орбитали.
потенциалу ионизации данной орбитали.
Совокупность молекулярных орбиталей молекулы называют её эл конфигураций, в основе которой лежат два принципа:
1. Принцип наименьшей энергии.(электроны занимают орбиты с наименьшей энергией).
2. Принцип Паули.(на однлй молекулярной орбитале не может быть больше двух электр с антипаоралельными спинами).
Движение электр в молекуле рассматривается как взаимодействие.
Электронная энергия молекал есть сумма энергий орбиталей за вычетом суммы энергий межэлектронного отталкивания + сумма энергий отталкивания между ядрами.

Направленность ковалентных связей.
Виды ковалентных связей:
1. Ионная
2. Ковалентная
3. Металлическая
4. Водородная связь обусловлена силой Вандервальса, при взаимодействии атомы, которые вступают в связь, сильно отличны по электроотрицательности.
K и F
Na и Cl [Na+] + [Cl-] 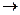 Na+Cl-
Na+Cl-
Na – e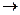 Na+
Na+
Cl + e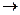 Cl-
Cl-
Взаимодействие осуществляется за счёт сил электростатического взаимодействия. За счёт перераспределения электроны образуют те или иные связи.
(2) Связь возникает между атомами, незначительно различными по энергии электроотрицательности. Практически отсутствует обмен Е, возникают общие электронные пары.
 |
Каждая пара находится на своей орбитали. Разновидностями является  и
и  связь.
связь.
Ковалентная полярная связь: ковалентные связи в случае их полярности имеют определённые направленности и определённую форму молекулы.
 Пример: 1. неполярная ковалентная связь
Пример: 1. неполярная ковалентная связь
2.  - молекула воды 2Р – электрона и 2 S – элемента
- молекула воды 2Р – электрона и 2 S – элемента
 |  | ||
Этот L определяет отчасти сложные свойства воды
3. 
 Гибридизация электронных облаков
Гибридизация электронных облаков 
4. 

 (Образуется линейная структура)
(Образуется линейная структура)

|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 478; Нарушение авторских прав?; Мы поможем в написании вашей работы!