
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тепловые эффекты химических реакций. Закон Гесса
|
|
|
|
Классификация кристаллов по виду хим. связи.
Лекция №4
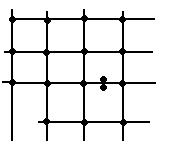
Плотность упаковки частиц кристалла.
Рассмотрим плотность упаковки элементарной ячейки.
Диаметр шара равен периоду идентификации.

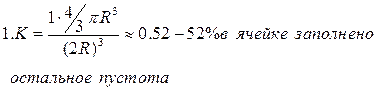
2.В объемоцентрическом кубе заполняется 68%.
3. Границентрический куб 74%.
Гексогональная плотнейшая упаковка с 74%.
1. Молекулярные кристаллы:
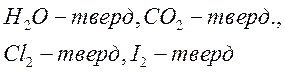
В молекулярных узлах решетки находится молекула. Между узлам такой решетки будет молекулярная связь (силы Вандервальса).
Силы Вандервальса:
Энергия: 0.4 - 4.2 кДж/моль так как эта энергия мала – кристаллы обладают:
-большой летучестью
-низкой температурой плавления.
-диэлектрики.
Плотность упаковки определяет хим. связи внутри молекулы. Для молекулярных кристаллов применимы все стеклометрические законы.
2. Атомные кристаллы с металлической связью (атомные металлические решетки)  .
.
Металлы реализуют металлическую связь, в силу металлической связи кристаллы обладают:
- хорошей теплопроводностью
- хорошие проводники
3. Атомные кристаллы с ковалентной связью: графит, алмаз, и тд.
В плоских решетках между узлами суммируется ковалентная связь:
-направленная
-насыщенная
За счет ковалентной связи кристаллы обладают:
- невысокое координационное число
- высокие температуры плавления
- большая твердость
- диэлектрики, полупроводники
- электронная проводимость
- энергия кристаллической решетки велика (она определяется прочностью ковалентной связи)
4. Ионные кристаллы:
NaCl, CsCl
В узлах – ионы, между которыми кулоновские взаимодействия.
Ионная связь: ненаправленная, ненасыщенная
Кристалл – как одна большая молекула.
За счет ионной связи кристаллы обладают:
- малая твердость
- диэлектрики, полупроводники
- высокая температура плавления
5. Реальные кристаллы: дефект кристаллов – нарушение дальнего порядка кристаллической решетки.
Для реальных кристаллов всегда имеет место дефект.
Дефект кристаллической решетки появляется:
- тепловое воздействие на кристалл
- возможно внедрение в решетку примесей
- механическое напряжение в кристалле
Дефекты:
1. точечные дефекты – это нарушение в 1-2 узла или междоузлие в расчете на 1 элементарную ячейку.
Классификация точечных дефектов (классификация по структуре)
А) Дефекты по Шоттки (по автору определившему структуру)
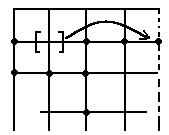
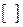 - вакансия
- вакансия
Тепловые вакансии возникают у меди
Б) Структура вычитания АВ
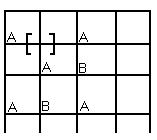
Часть узлов в подрешетке В не занято. АВ 1-0. Это однокристальная структура вычитания
PbS0,9995 (пять десятитысячных в подрешетке серы отсутствуют)
Pb0.9995S имеет место двусторонняя структура вычитания:
TiO0.7-1.3 (30 % узлов может быть не занято в подрешетке кислорода и 30% у Ti)
В) Структура …….. (твердые растворы)
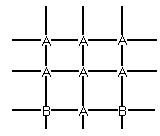
Ra=Rb. Узлы заполняют друг друга.
Г) Структура внедрения (твердые растворы с ограниченной растворимостью)
В) внедряется в междоузлие.
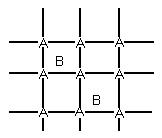
Д) Структура по Френнелю (структура смещения).
[A]+()=[ ]+(A). ()-междоузлие
Точечные дефекты показывают то, что существуют соединения переменного состава. Эти дефекты с атомной ковалентной связью.
От количества дефектов зависят электрофизические свойства.
2. Протяжённые – это когда нарушения дальнего порядка распространяются на большое количество.
а) трещина в кристалле
б) микроверны: открытые
(пустота), закрытые
в) мозаика
г) дислокация – нарушение дальнего порядка вдоль линии (линия дислокации)
д) краевые.
Дислокация влияет на механические свойства кристалла.
Основные элементы химической термодинамики.
1. Основные понятия и определения:
Химическая термодинамика – изучающая период цикла при химических реакциях в виде работы.
Термодинамика:
- общая
- статистическая
- химическая (вид термодинамики в химических процессах)
Она изучает:
1. Тепловые эффекты химических и физико-химических процессов.
2. определяет возможности происхождения химических процессов.
3. Определяет предел протекания химической реакции (условие равновесия химической реакции).
Объект изучения в химической термодинамике – химическая система. Химическая система – совокупность химических веществ, находящихся во взаимодействии и мысленно или фактически обособленно от окружающей среды.
Вещества, из которых состоит химическая система – компоненты.
Химические системы могут быть:
Гомогенными (физически и химически однородная система – в ней отсутствуют поверхности раздела) – однофазная.
Гетерогенными (физически и химически неоднородная система – в ней обязательно присутствуют поверхности раздела) – многофазная.
Фаза – гомогенная ёмкость гетерогенной системы, ограниченная поверхностью раздела.
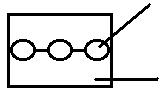
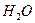
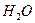 - Твердый лед
- Твердый лед
Вода
Н2О – твёрдый лёд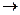 2 фазы.
2 фазы.
Н2О – вода.
Термодинамическая химическая система характеризуется:
Фазовым состоянием:
Н2(2) + О2(2) = 2Н2О – газообразная вода.
2Н2О + О2 = 2Н2О(2) – жидкая вода.
Параметры состояния:
Интенсивные (не зависящие от размеров и массы системы).
Экстенсивные (зависящие от размеров и массы системы).
Эти параметры обладают аддитивностью (их можно исследовать).
P, V, T – комбинационное распределение.
По отношению к окружающей среде системы бывают:
- изолированные (как классы обмена с окружающей средой)
- закрытые (есть электрообмен с окружающей средой).
- Открытые (есть электрообмен с окружающей средой, но нет массообмена). Совокупность термодинамических параметров определяет состояние системы:
Различают:
- равновесное состояние (если термодинамические параметры с течением времени не изменяются и сохраняют постоянные значения в пределах фазы).
- Неравновесное состояние.
Изменение хотя бы одного из параметров вызывает процесс.
Различают:
- равновесный (обратимый) – проходит через непрерывную последовательность равновесных состояний (или когда при изменении в окружающей среде процесс меняется).
- Неравновесный (необратимый процесс) Т=const.
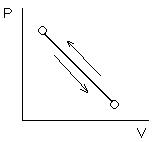 |
Бесконечно уменьшить давление и бесконечно увеличить объём, и если в окружающей среде нет изменений, то процесс обратимый.
 |
Путь туда и обратно не одинаков. Реальные процессы необратимы, идеальные – обратимы.
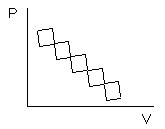
В химической термодинамике вводится понятие стандартных условий:
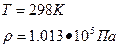
Высокомерность:
1 закон термодинамики – понятие внутренней энергии, энтропии.
Начало термодинамики: энергия не возникает из ничего, а переходит из одной формы в другую в строго эквивалентных количествах. Невозможно получить энергию, не затратив работу. Изменение внутренней энергии в системе равно 0.

q – теплота – мера передачи энергии (за счёт разности Т).
передача теплоты зависит от пути процесса.
Работа – мера передачи энергии, за счёт перемещения массы, под действием различных сил.
Работа зависит от пути процесса.
Внутренняя энергия системы – полная энергия.
U=Ek+Eп (атомов, молекул).
Абсолютную величину внутри энергии определить нельзя, а можно определить только изменение.
U=S (состояние системы).
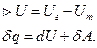
Химические процессы проводят при:
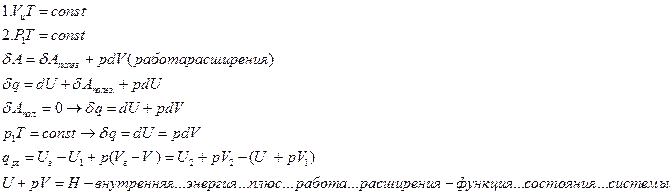
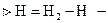 не зависит от пути состояния.
не зависит от пути состояния.
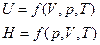
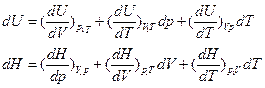
1) если V1T=const 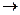
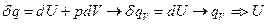
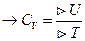
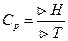
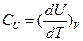 -истинная теплоёмкость.
-истинная теплоёмкость.
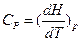
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 344; Нарушение авторских прав?; Мы поможем в написании вашей работы!