
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа расширения одного моля идеального газа
|
|
|
|
Лекция №5.
И следствия из него.
Тепловые эффекты химических реакций – теплота, которая выделяется или поглощается при химической реакции при данных условиях:
V1T=const. qV,T= U
U
p1T=const. qp,T= H
H
Для сравнения тепловых эффектов вводят понятие стандартного состояния вещества. Для газов принимают такое состояние, при котором 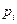 =1атм.
=1атм.
Жидкость Сi=1 моль/литр.
Условия: газ расширяется в пустоту без противодействия.
Работа расширения: 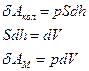
Для различных процессов: 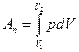
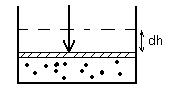
Изобарический процесс: p = const.
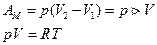
 -для одного моля газа
-для одного моля газа
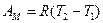
Изотермический процесс: f=const.
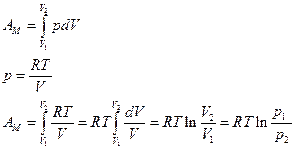
Изохорический процесс: V=const.
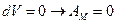
Теплоёмкость: 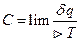 при
при  стремящемся к 0 – истинная теплоёмкость.
стремящемся к 0 – истинная теплоёмкость.
C = a + bT + vT2t – степенная функция температуры.
Закон Гесса позволяет определить тепловой эффект реакции, не проводя самой реакции.
Следствие закона Гесса: теплотой образования называется тепловой эффект реакции получения данного соединения из простых веществ, находящихся в наиболее устойчивом состоянии при данном давлении и температуре.
Закон Кирхгофа: зависимость теплового эффекта процесса от температуры.
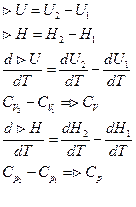
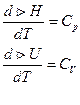
Закон Кирхгофа – температурный коэффициент теплового эффекта процесса в дифференциальной форме равен изменению теплоёмкости, происходящей в результате процесса.
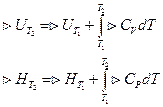
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1750; Нарушение авторских прав?; Мы поможем в написании вашей работы!