
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Частица, предоставляющая для связи двухэлектронное облако, называется донором; частица со свободной орбиталью, принимающая эту электронную пару, называется акцептором
|
|
|
|
Если соединяются два атома с различными значениями электроотрицательности, то облако отрицательного заряда общей электронной пары смещается в сторону более электроотрицательного атома, а образующаяся связь является полярной.
Если молекула образована двумя атомами с близкими значениями электроотрицательности, то распределение отрицательного заряда общего электронного облака более или менее симметрично. В предельном случае, если молекула образована двумя одинаковыми атомами, то отрицательный заряд электронов распределяется между ними поровну. В этом случае возникающая в молекуле связь неполярная.
Ковалентная связь может быть полярной и неполярной.
Электроотрицательность элемента это способность атомов данного элемента оттягивать к себе общую электронную пару при образовании химической связи с атомами других элементов.
Таким образом, электроотрицательность характеризует способность атомов элемента удерживать электроны (как электроны своей электронной оболочки, так и дополнительные электроны — в случае неметаллов).
Атомы могут быть связаны между собой более чем одной электронной парой. Число электронных пар, связывающих два атома, называется кратностью связи между этими атомами. Простой (ординарной) связи соответствует одна общая электронная пара, двойной или тройной связи — соответственно две или три общие электронные пары.
 |
В ряде случаев число непарных электронов увеличивается в результате возбуждения атома, вызывающего распад двухэлектронных облаков на одноэлектронные. Например, атом углерода в основном состоянии имеет два непарных электрона (2s22p2), а при возбуждении одного из 2 s -электронов в 2р-состояние возникают четыре непарных электрона:

Вследствие этого атом углерода может соединяться, например, с четырьмя атомами фтора (2s22p5), имеющими по одному непарному электрону:
 |
Возбуждение атомов до нового валентного состояния требует затраты определенной энергии, которая компенсируется энергией, выделяемой при образовании связей С—F.
Б) Рассмотрим пример донорно-акцепторного механизма образования ковалентной связи. Он характерен для взаимодействия частиц, одна из которых имеет пару электронов А:, другая — свободную орбиталь В:
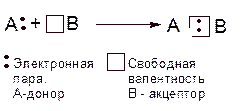
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и свободной орбитали другого называется донорно-акцепторным.
|
|
|
Дата добавления: 2013-12-13; Просмотров: 977; Нарушение авторских прав?; Мы поможем в написании вашей работы!