
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантование энергии, момента импульса и проекции момента импульса
|
|
|
|
Атом водорода в квантовой механике.
Результаты, достигнутые боровской теорией в решении задачи об энергетических уровнях электрона в водородоподобных системах, могут быть получены в квантовой физике без привлечения постулатов Бора. Для этого осуществляют решение стационарного уравнение Шрёдингера, при рассмотрении поведения электрона в атоме:
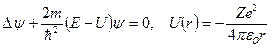 , Е – полная энергия электрона в атоме:
, Е – полная энергия электрона в атоме:
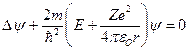 .
.
Решение уравнения Шрёдингера в сферической системе координат r, ϴ, φ показывает, что значения энергии, которыми может обладать электрон:
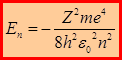 – совпадает с выражением из теории Бора, n – главное квантовое число. Таким образом, последовательное решение уравнения Шрёдингера для электрона в водородоподобной системе приводит к энергетическим уровням без использования каких-либо постулатов.
– совпадает с выражением из теории Бора, n – главное квантовое число. Таким образом, последовательное решение уравнения Шрёдингера для электрона в водородоподобной системе приводит к энергетическим уровням без использования каких-либо постулатов.
Главное квантовое число n определяет энергетические уровни электрона для водородоподобной системы:
 , n = 1, 2, 3, …
, n = 1, 2, 3, …
Для атома водорода в основном состоянии:

Его решение 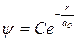 , где С = const (из условия нормировки). Дифференцируя:
, где С = const (из условия нормировки). Дифференцируя:
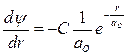 ,
, 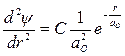 . После подстановки в уравнение:
. После подстановки в уравнение:
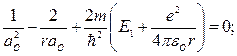 или
или 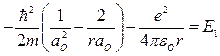 .
.
Это выполняется при:
 ,
, 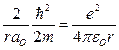 .
.
Отсюда:  – первый боровский радиус;
– первый боровский радиус;
 – энергия основного состояния атома водорода.
– энергия основного состояния атома водорода.
 Следовательно:
Следовательно: 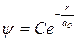 , а вероятность того, что электрон находится в объеме dV шарового сегмента:
, а вероятность того, что электрон находится в объеме dV шарового сегмента:
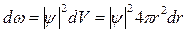
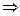
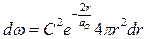 .
.
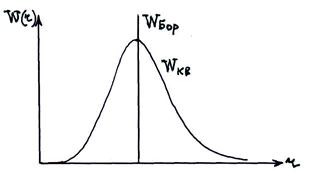
Исследуем на экстремум функцию  :
:
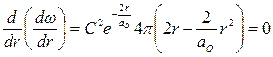 ;
;  .
.
Боровские орбиты электрона представляют собой геометрические места точек, в которых с наибольшей вероятностью может быть обнаружен электрон.
Решение уравнения Шрёдингера для водородоподобной системы в сферических координатах позволяет получить важные результаты. Прежде всего, что момент импульса электрона в атоме квантуется по формуле:
|
|
|
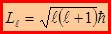 ,
, 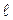 = 0, 1, 2, …, (n – 1) – орбитальное квантовое число.
= 0, 1, 2, …, (n – 1) – орбитальное квантовое число.
В соответствии со спектроскопией, состояние электрона, характеризующееся квантовыми числами:
ℓ =0 называют s -состоянием,
ℓ =1 называют p -состоянием,
ℓ =2 называют d -состоянием,
ℓ =3 называют f -состоянием и т.д.
Значение главного квантового числа указывается перед условным обозначением орбитального квантового числа. Например, электрон в состояниях с n =2 и ℓ =0 и ℓ =1 обозначаются соответственно символами 2 s и 2 p. Из курса электричества и магнетизма известно, что момент импульса электрона 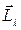 и пропорциональный ему магнитный момент
и пропорциональный ему магнитный момент 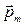 связаны между собой и перпендикулярны к плоскости орбиты электрона:
связаны между собой и перпендикулярны к плоскости орбиты электрона:
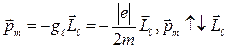 , где
, где 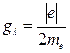 – гиромагнитное отношение.
– гиромагнитное отношение.
В квантовой механике не может быть определено положение плоскости орбиты электрона. Поэтому для указания ориентации векторов 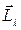 и
и 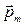 выбирают направление либо внешнего магнитного поля, в котором находится атом, либо направление внутреннего магнитного поля, создаваемого электронами и ядром атома. На языке теории Бора возможность любых ориентаций вектора
выбирают направление либо внешнего магнитного поля, в котором находится атом, либо направление внутреннего магнитного поля, создаваемого электронами и ядром атома. На языке теории Бора возможность любых ориентаций вектора 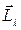 означает, что плоскость орбиты электрона может быть ориентирована произвольно по отношению к внешнему магнитному полю. Однако такое положение оказалось ошибочным. Существует пространственное квантование: вектор момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых проекция
означает, что плоскость орбиты электрона может быть ориентирована произвольно по отношению к внешнему магнитному полю. Однако такое положение оказалось ошибочным. Существует пространственное квантование: вектор момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых проекция 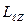 вектора
вектора 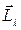 на направление Z внешнего магнитного поля принимает квантовые значения, кратные
на направление Z внешнего магнитного поля принимает квантовые значения, кратные 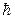 :
:
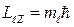 , где mℓ – магнитное квантовое число, принимающее значения:
, где mℓ – магнитное квантовое число, принимающее значения:
 , здесь ℓ – орбитальное квантовое число.
, здесь ℓ – орбитальное квантовое число.
Следовательно, вектор 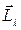 может принимать
может принимать 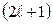 ориентаций в пространстве.
ориентаций в пространстве.
p-состояние (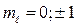 ) d-состояние
) d-состояние 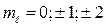
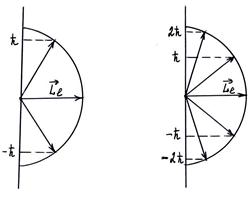
Квантовые числа и их значения являются следствием решений уравнения Шрёдингера и условий однозначности, непрерывности и конечности, налагаемых на волновую функцию ψ. Кроме того, так как при движении электрона в атоме существенны волновые свойства электрона, то квантовая механика вообще отказывается от классического представления об электронных орбитах. Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объёма.
|
|
|
Вероятность обнаружения электрона в различных частях атома различна. Электрон при своём движении как бы «размазан» по всему объёму, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных частях объёма атома. Квантовые числа n и ℓ характеризуют размер и форму электронного облака, а квантовое число m характеризует ориентацию электронного облака в пространстве.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 6454; Нарушение авторских прав?; Мы поможем в написании вашей работы!