
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионизация воды
|
|
|
|
Основание – вещество, дающее электроны для образования химической связи – донор электрона.
Теория Льюиса
 Кислота – вещество, принимающее электронные пары – акцептор электрона;
Кислота – вещество, принимающее электронные пары – акцептор электрона;
Т.е. между кислотой и основанием образуется связь по донорно – акцепторному механизму.


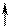


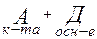 Д А
Д А
 :
: 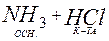 NH4Cl [H3N: H] Cl
NH4Cl [H3N: H] Cl
Данная теория рассматривает разные химические реакции как однотипные.
Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют внутреннюю связь.
 H+ + OH- H2O
H+ + OH- H2O

 H +:OH- HO: Н
H +:OH- HO: Н
К-ТА ОСН-Е
Так, кислоту по Бренстеду можно рассматривать как частный случай льюисовских кислот, т.к. протон характеризуется большим сродством к электронной паре, и может рассматриваться по Льюису, как кислота.
Вода слабый электролит и слабо диссоциирует по уравнению

 Н2О Н+ + ОН‾
Н2О Н+ + ОН‾
Установлено, что концентрация Н+ и ОН‾ = 10‾7 г-ион/л
[Н+] = [ОН‾] = 10‾7
Для Н2О и разбавленных водных растворов при постоянной температуре произведение концентраций ионов Н+ и ОН‾ есть величина постоянная и называется ионным произведением воды.
Кн2о = [Н+] * [ОН‾] = 10‾7 * 10‾7 = 10‾14
Растворы, в которых концентрация ионов Н+ и ОН‾ ионов одинаковы называются нейтральными растворами. [Н+] = [ОН‾]
В кислых растворах [Н+] > [ОН‾]
В щелочных [ОН‾] > [Н+]
Но как бы не менялась реакция растворов, произведение концентрации остается постоянной величиной. Т.е. если в раствор добавляем Н+, то концентрация ОН‾ - понизится, но произведение останется 10‾14. Поэтому зная концентрацию одного иона можно рассчитать концентрацию другого

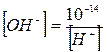
Таким образом, реакцию любого раствора можно охарактеризовать концентрацией одного из этих ионов, и принято характеризовать ее концентрацией ионов Н+. Удобно вместо концентрации Н+ указывать ее десятичный логарифм, взятый с обратным знаком. Эта величина называется водородным показателем и обозначается через рН.
рН = - lg [Н+]
[Н+] = 10‾5 моль/л; рН = 5
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 468; Нарушение авторских прав?; Мы поможем в написании вашей работы!