
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
Таким образом, при
рН = 7 – реакция раствора нейтральная;
рН < 7 – реакция раствора кислая;
рН > 7 – реакция раствора щелочная.
Приблизительное значение рН можно определить с помощью индикаторов, окраска которых меняется в зависимости от реакции среды.
В растворах кислот и оснований концентрация ионов водорода и гидроксильных ионов зависит от концентрации вещества и коэффициента активности этих ионов.
[Н+] =  f (Н+) * С(1/Z к-ты)
f (Н+) * С(1/Z к-ты)
рН = - lg f (Н+) * С(1/Z)
Аналогично рассуждаем для щелочей, ведь в их растворах нет ионов Н+, но для расчета рН используем
рН + рОН = 14
Таким образом, мы рассмотрели, что происходит при диссоциации кислот, оснований, самой воды, рассмотрим, что происходит при растворении солей.
При растворении в воде солей происходит смещение равновесия ионизации воды. Если соль образованна анионом слабой кислоты, то при взаимодействии с Н2О, анион образует слабую кислоту, ионы ОН‾ находятся в избытке и раствор станет щелочным.
 А‾ + НОН НА + ОН‾
А‾ + НОН НА + ОН‾
Т.е. гидролиз идет по аниону, и наоборот, если соль образована ионом слабого основания, то при гидролизе образуется это основание и раствор станет кислым
 Кt+ + НОН КtОН + Н+
Кt+ + НОН КtОН + Н+
 Гидролиз соли – это обратимый процесс взаимодействия ионов слабого электролита, входящего в состав соли, с водой, что приводит к образованию слабого электролита и сдвигу ионного равновесия воды.
Гидролиз соли – это обратимый процесс взаимодействия ионов слабого электролита, входящего в состав соли, с водой, что приводит к образованию слабого электролита и сдвигу ионного равновесия воды.
Интенсивность любого обратимого процесса характеризуется константой равновесия, для реакций гидролиза константа равновесия равна константе гидролиза. Например,

 – ионное произведение воды
– ионное произведение воды
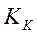 – константа диссоциации кислоты
– константа диссоциации кислоты
Чем слабее кислота, тем полнее гидролиз.
Аналогичные рассуждения для гидролиза соли образованной сильной кислотой и сильным основанием.
Гидролиз зависит от внешних факторов – от температуры, концентрации. Повышение температуры способствует гидролизу; охлаждение уменьшает. Увеличение концентрации уменьшает гидролиз. В соответствии с принципом Ле Шателье для подавления гидролиза необходимо добавить щелочь, тем самым увеличивая концентрацию ОН‾.
Таким образом, гидролитические процессы вместе с процессами растворения играют важную роль в обмене веществ. Действие многих лекарственных препаратов связано с их склонностью к гидролизу. С этим необходимо считаться при одновременном применении нескольких лекарственных веществ.
Растворимость
Растворимость – это способность вещества растворяться в том или ином растворителе. Численно растворимость равна концентрации насыщенного раствора. Растворимость выражается в тех же единицах, что и концентрация или через массу вещества в 100 г растворителя. Эту величину называют коэффициентом растворимости.
Процесс растворения зависит от:
1. Химической природы растворителя и растворенного вещества.
2. Наличия сопутствующих веществ.
3. Условия растворения – температуры, давления, объема.
Не обнаружены строгие математические закономерности, позволяющие рассчитать возможности растворения вещества. Принято считать, что подобное растворяется в подобном – металлы в металлах, жиры в жирах, углеводы в углеводах. Величина растворимости зависит от полярности молекул растворителя и растворяющегося вещества. Установлено, что полярные вещества растворяются в полярных растворителях, неполярные – в неполярных. Например: в воде – кислоты, соли. В органических растворителях – жиры, жироподобные вещества.
На растворимость веществ оказывает влияние температура. В тех случаях, когда процесс растворения является эндотермическим, то повышение температуры приводит к увеличению растворимости. Когда растворение – процесс экзотермический, с ростом температуры растворимость понижается. Зависимость растворимости от температуры удобно изображать графически. Данные кривые называют кривыми растворимости.
Растворение газов почти всегда сопровождается выделением теплоты, поэтому растворимость снижается с повышением температуры.
Давление практически не влияет на растворимость твердых веществ в жидкостях, но существенно влияет на процесс растворения газов в жидкой среде. Чем выше давление, тем больше растворимость.
При растворении веществ получают следующие растворы
1. насыщенные;
2. пересыщенные;
3. ненасыщенные.
Раствор, содержащий при данной температуре максимальное количество растворенного вещества и находящийся в равновесии с избытком растворенного вещества, называют насыщенным.Пересыщенный раствор – раствор, концентрация которого выше, чем в насыщенном. Раствор с меньшей концентрацией, чем насыщенный, называют ненасыщенным.
При растворении твердого вещества растворение прекращается когда получается насыщенный раствор, т.е. между растворенным веществом и находившимися в растворе молекулами этого вещества устанавливается равновесие (сколько молекул отрывается, столько оседает).
При растворении электролита в растворе находятся не молекулы, а ионы и равновесие устанавливается между твердым веществом (соль) и ионами. Например:

 СаSО4 Са +2 + SО4 ‾2
СаSО4 Са +2 + SО4 ‾2
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1107; Нарушение авторских прав?; Мы поможем в написании вашей работы!