
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно – восстановительные реакции
|
|
|
|
Все реакции можно разделить на 2 группы: реакции, в которых степень окисления атомов остается постоянной и реакции, идущие с изменением степени окисления.
 Окислительно–восстановительными реакциями называют химические процессы, сопровождающиеся переносом электронов от одних молекул или ионов к другим.
Окислительно–восстановительными реакциями называют химические процессы, сопровождающиеся переносом электронов от одних молекул или ионов к другим.
 Окислительно–восстановительными реакциями называют химические процессы, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними.
Окислительно–восстановительными реакциями называют химические процессы, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними.
Например:

В этом процессе меняется степень окисления Zn и О2.
 Вещества, атомы или ионы которого отдают электроны, называются восстановителями. Вещества, которые присоединяют электроны, называются окислителями.
Вещества, атомы или ионы которого отдают электроны, называются восстановителями. Вещества, которые присоединяют электроны, называются окислителями.
Zn отдает электрон, О2 приобретает, соответственно Zn – восстановитель, О2 – окислитель. При этом протекает 2 процесса – окисление и восстановление.
 Процесс потери (отдачи) электрона, сопровождающийся повышением степени окисления, называется окислением .
Процесс потери (отдачи) электрона, сопровождающийся повышением степени окисления, называется окислением .
Процесс присоединения электрона, сопровождающийся понижением степени окисления, называется восстановлением.
В ходе окислительно-восстановительной реакции оба процесса протекают одновременно, и число электронов, отданных при окислении, равно числу электронов принятых при восстановлении.
Окислитель, принимая электрон, приобретает восстановительные свойства, т.е. переходит в сопряженный восстановитель.

 окислитель +
окислитель + 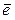 сопряженный восстановитель
сопряженный восстановитель
И наоборот, восстановитель, отдавая электрон, приобретает окислительные свойства, превращается в сопряженный окислитель.

 восстановитель -
восстановитель - 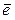 сопряженный восстановитель
сопряженный восстановитель
Т.е. окислительно-восстановительную реакцию можно представить в виде двух окислительно-восстановительных превращений.

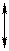

 окислитель I + восстановитель II
окислитель I + восстановитель II
сопряженный восстановитель I + сопряженный окислитель II
Например:


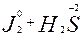


окисл. восст. сопр. сопр.
восст. окисл.

сопряженная окислительно-восстановительная пара
I II
Об окислительно-восстановительных свойствах простых веществ и соединений можно судить пользуясь периодической системой Д.И. Менделеева. Типичные окислители это:
1. Простые вещества, атомы которых обладают большей электроотрицательностью (элементы 6 и 7 групп);
2. Ионы с дефицитом электронов
А) это катионы с высшей или большей степенью окисления: Pb+4, Fe+3
Б) сложные ионы, в которых электроотрицательный элемент имеет высшую или большую степень окисления:
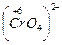 ;
;  ;
;  ;
; 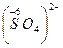 ;
; 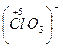
3. Кислоты, более сильные окислители, чем их соли, причем чем выше концентрация кислот, тем выше окислительная активность.
KNO3 – не обладает окислительными свойствами
HNO3 – разбавленная – слабый окислитель
HNO3 – концентрированная – сильный окислитель
4. Сильными окислителями являются пероксиды Ме.
К типичным восстановителям относят:
1. Простые вещества, атомы которых обладают малой электроотрицательностью (Ме I, II групп). Восстановительная способность тем больше, чем ниже энергия ионизации этих атомов.
2. Простые анионы Cl-, S-2, а также сложные анионы, в которых электроположительный элемент не имеет максимальной степени окисления  ;
;  .
.
3. Катионы, в которых элемент проявляет не максимальную степень окисления и она может возрастать - Sn+2, Fe+2.
4. Некоторые вещества при повышении температуры С, СО, Н2.
Вещества, с элементами в максимальной или минимальной степени окисления могут быть только окислителями или только восстановителями.
PbO2; H2SO4; HNO3; K2Cr2O7 - окислители
H2S; NH3 - восстановители
Вещества, содержащие элементы в промежуточной степени окисления, могут быть как окислителями (при действии сильного восстановителя), так и восстановителями (при действии сильного окислителя). Например, H2SO3; HNO2.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 897; Нарушение авторских прав?; Мы поможем в написании вашей работы!