
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление окислительно-восстановительных реакций
|
|
|
|
Факторы, влияющие на протекание окислительно-восстановительных реакций
Протекание окислительно-восстановительных реакций зависит от природы взаимодействующих веществ и от условий проведения реакций.
1. От концентрации реагента
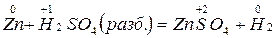
окислитель Н+
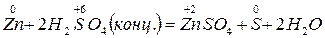
окислитель S+6
2. Температуры реакции
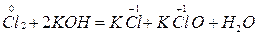 - на холоду
- на холоду
 - при нагревании
- при нагревании
3. Наличия катализатора
Без катализатора 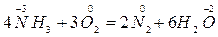
С катализатором 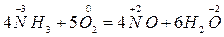
4. Влияние характера среды – окислительно-восстановительные реакции протекают в разных средах. Например:
1) Кислая среда

2) Нейтральная среда
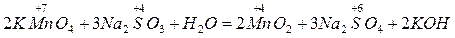
3) Щелочная среда
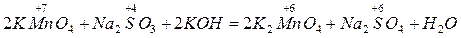 ,т.е.
,т.е.
 |
Т.е. в окислительно-восстановительных реакциях, протекающих в растворах, принимают участие ионы Н+ и ОН‾, которые не только способствуют передаче электронов от восстановителя к окислителю, но и связывают компоненты данных реакций.
В основе определения направления лежит правило:
 Окислительно-восстановительные реакции самопроизвольно протекают всегда в сторону превращения сильного окислителя в слабый сопряженный восстановитель или сильного восстановителя в слабый сопряженный окислитель.
Окислительно-восстановительные реакции самопроизвольно протекают всегда в сторону превращения сильного окислителя в слабый сопряженный восстановитель или сильного восстановителя в слабый сопряженный окислитель.
Прогнозировать направление окислительно-восстановительной реакции можно с помощью анализа значений окислительно-восстановительных потенциалов сопряженных пар.
Например: реакцию
 Zn0 + Cu+2 Zn+2 + Cu0
Zn0 + Cu+2 Zn+2 + Cu0
восст. I окисл. II окисл. I восст. II
Можно представить в виде 2-х пар


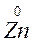 - 2
- 2
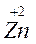
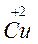 + 2
+ 2
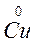

 (
(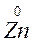
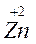 + 2
+ 2 ) (
) (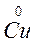
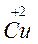 + 2
+ 2 )
)
Т.е. на границе металл – раствор возникает разность потенциалов, которая называется окислительно-восстановительным (ОВ) или электродным потенциалом.
Чтобы окислительно-восстановительные потенциалы (j) отдельных пар можно было сравнить, их определяют в стандартных условиях (T = 2980K, 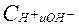 = 1 моль/л). Полученные значения называют стандартными окислительно-восстановительными (электродными) потенциалами
= 1 моль/л). Полученные значения называют стандартными окислительно-восстановительными (электродными) потенциалами 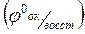 . Данные величины различных сопряженных пар приводятся в таблицах. Положительный знак потенциала означает, что полуреакция самопроизвольно протекает в данном направлении. Отрицательный – самопроизвольно протекает обратная реакция, т.е. данное вещество должно окислиться, а протоны восстановятся до свободного вещества.
. Данные величины различных сопряженных пар приводятся в таблицах. Положительный знак потенциала означает, что полуреакция самопроизвольно протекает в данном направлении. Отрицательный – самопроизвольно протекает обратная реакция, т.е. данное вещество должно окислиться, а протоны восстановятся до свободного вещества.
Суть окислительно-восстановительных реакций заключается в конкуренции за присоединенные электроны между участвующими веществами. При этом электрон присоединяет та сопряженная пара, окисленная форма которой сильнее его удерживает. Это можно изобразить схемой:
φ1 φ2

 восстановитель I окислитель I +
восстановитель I окислитель I +  + окислитель II восстановитель II
+ окислитель II восстановитель II
 j1 > j2
j1 > j2
 j1 < j2
j1 < j2
(смещения равновесия)
Сопоставляя потенциалы сопряженных пар, можно заранее определить направление реакции. При взаимодействии двух сопряженных окислительно-восстановительных пар окислителем всегда будет окисленная форма той пары, потенциал которой имеет более положительное значение.
Например, в реагирующей смеси J2 + H2S имеются 2 сопряженные пары, потенциал которых равен:
 J20 + 2
J20 + 2 2J ‾ j = + 0,54 B
2J ‾ j = + 0,54 B
 S0 + 2
S0 + 2 S‾2 j = + 0,17 B
S‾2 j = + 0,17 B
J2 (по стандартному потенциалу) более сильный окислитель, поэтому в реакции J2 будет окислителем, H2S - восстановителем.
Т.е. идет реакция
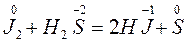

 окислитель J20 + 2
окислитель J20 + 2 2J ‾ процесс восстановления
2J ‾ процесс восстановления

 восстановитель S‾2 − 2
восстановитель S‾2 − 2  S0 процесс окисления
S0 процесс окисления
При малом отличии окислительно-восстановительных потенциалов сопряженных пар процесс является обратимым. Кроме окислительно-восстановительных потенциалов для определения направления данных реакций используют ее величину ЭДС.
 ЭДС окислительно-восстановительной реакции в стандартных условиях равна разности стандартных потенциалов сопряженных окислительно-восстановительных пар, участвующих в реакции
ЭДС окислительно-восстановительной реакции в стандартных условиях равна разности стандартных потенциалов сопряженных окислительно-восстановительных пар, участвующих в реакции
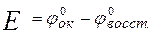
Условием протекания реакции является положительное значение ЭДС.
Например: Выяснить какой галогенид KJ или KBr восстанавливает FeCl3.
Ионная форма реакции:

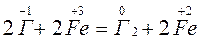
Сопряженные пары и их потенциалы:
Fe+3 +  = Fe+2 j = + 0,77 B
= Fe+2 j = + 0,77 B
1) Br2 + 2 = 2Br ‾ j = + 1,07 B
= 2Br ‾ j = + 1,07 B
2) J2 + 2 = 2J ‾ j = + 0,54 B
= 2J ‾ j = + 0,54 B
ЭДС1 = 0,77 – 1,07 = − 0,30 В
ЭДС2 = 0,77 – 0,54 = + 0,23 В
Т.е. из двух данных галогенидов, только KJ восстанавливает FeCl3. Если Е = 0, то в системе возникает равновесие.
Все биохимические окислительно-восстановительные процессы идут в присутствии ферментов (оксидоредуктаз). В их состав входят кофакторы или коферменты. Коферментами являются катионы переходных металлов (Fe, Cu, Mn, Mo), которые образуют с белком комплексное соединение. Основная особенность этих соединений – это способность быть окислителем и восстановителем, т.к. они находятся в виде сопряженных пар – окисленной и восстановленной форме.
Особенность биохимических окислительно-восстановительных реакций заключается в их много ступенчатости. Данные процессы – гликолиз, цикл Кребса, окислительное фосфорилирование – включают много стадий, которые идут под действием ферментов. Все ферменты определенного процесса объединяются с помощью межмолекулярных связей в ансамбли. Это обеспечивает химическое превращение субстрата постепенно, как на конвеере.
Окислительно-восстановительные реакции можно разделить на
1. межмолекулярные;
2. внутримолекулярные;
3. самоокисления – самовосстановления (диспропорционирования).
Межмолекулярные окислительно-восстановительные реакции протекают с изменением степени окисления атомов в разных молекулах
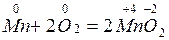
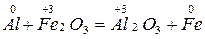
Своеобразно реагирует перекись Н2О2 – перекись водорода
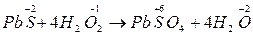
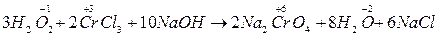
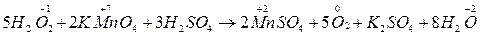
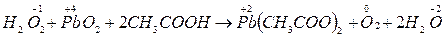
Н2О2 – выступает как окислитель, так и восстановитель; в реакциях где является восстановителем, выделяется О2  .
.
Внутримолекулярные окислительно-восстановительные реакции идут с изменением степени окисления атомов в разных элементах в одной и той же молекуле. Обычно это реакции термического разложения веществ:
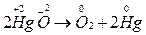
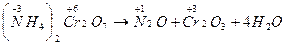
Реакции самоокисления – самовосстановления протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Эти реакции характерны для тех веществ, в которых есть атомы с промежуточной степенью окисления.
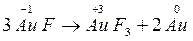
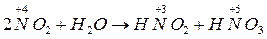
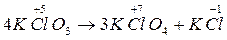
Внутримолекулярные реакции окисления – восстановления, в которых происходит выравнивание степени окисления атомов одного и того же элемента называется контрдиспропорционирования (коммутации).
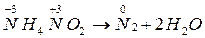
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 12438; Нарушение авторских прав?; Мы поможем в написании вашей работы!