
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процессе
|
|
|
|
Качественный пример изменения энтропии при неравновесном
Лекция 4
Пусть газ под поршнем расширяется из состояния 1 (объем газа 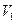 ) в состояние 2 (объем газа
) в состояние 2 (объем газа 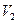 ) с помощью равновесного (обратимого) процесса (сплошная линия на диаграмме рис. 2,10,б) и неравновесного (необратимого) процесса (пунктирная линия на рис. 2.10,б).
) с помощью равновесного (обратимого) процесса (сплошная линия на диаграмме рис. 2,10,б) и неравновесного (необратимого) процесса (пунктирная линия на рис. 2.10,б).
Отметим, что для неравновесного расширения газа в формуле для
работы (2.40) необходимо брать внешнюю силу, которая действует на поршень с внешней стороны, а не силу давления газа, как при равновесном процессе расширения. Неравновесный процесс расширения происходит с конечной скоростью, поэтому внешняя сила будет меньше силы давления газа на поршень и работа неравновесного расширения будет меньше работы при равновесном его расширении
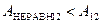 . (2.48)
. (2.48)
В крайнем случае, случае расширения газа в пустоту, она будет равна нулю.
Давление газа как параметр его состояния при неравновесном процессе не будет иметь определенного значения для всего газа - непосредственно под поршнем он будем принимать наименьшие значения. В связи с этим неравновесный процесс нельзя изображать на диаграммах состояния, его можно обозначить, например, пунктирной линией (рис. 2.10,б).
При достижении поршнем конечного объема 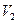 неравновесный процесс заканчивается. Затем протекает процесс, переводящий газ из неравновесного состояния в равновесное состояние, при этом процессе изменение энтропии будет положительным (
неравновесный процесс заканчивается. Затем протекает процесс, переводящий газ из неравновесного состояния в равновесное состояние, при этом процессе изменение энтропии будет положительным (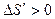 ). Действительно, запишем первый закон термодинамики для равновесного (обратимого) и неравновесного (необратимого) процессов перехода газа из состояния 1 в состояние 2
). Действительно, запишем первый закон термодинамики для равновесного (обратимого) и неравновесного (необратимого) процессов перехода газа из состояния 1 в состояние 2
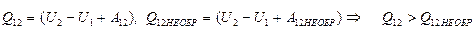 .
.
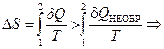
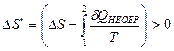 ,
, 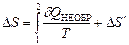 . (2.49).
. (2.49).
В итоге изменение энтропии будет одинаковым для двух процессов перехода (энтропия является функцией состояния системы), а интегралы от приведенной теплоты будут различаться.
|
|
|
Для замкнутой системы, в которой в начальный момент времени было неравновесное состояние, изменение энтропии будет больше нуля (из формулы (2.49) следует 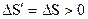 ).
).
Рассмотренный пример подтверждает формулу (2.46), но не является доказательством второго начала термодинамики, этот закон не доказывается, он является следствием опытных данных.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 233; Нарушение авторских прав?; Мы поможем в написании вашей работы!