
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 5. *2.18. Примеры расчета изменения энтропии для неравновесных процессов.
|
|
|
|
*2.18. Примеры расчета изменения энтропии для неравновесных процессов.
Если необходимо рассчитать изменение энтропии произвольного  неравновесного процесса перехода системы (идеальный газ) из одного состояния (параметры состояния
неравновесного процесса перехода системы (идеальный газ) из одного состояния (параметры состояния 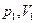 ) в другое (параметры состояния
) в другое (параметры состояния  ), необходимо использовать тот факт, что энтропия является функцией состояния системы, и рассчитать
), необходимо использовать тот факт, что энтропия является функцией состояния системы, и рассчитать
Рис. 2.13 изменение энтропии для
равновесного процесса перехода. Этот процесс наиболее удобен, так как состоит из нескольких изопроцессов (например, изобарический 1-3, и изохорический 3-2, рис. 2.13,б), что позволяет использовать формулы, приведенные в п. 2.2.4 пункт 1 (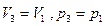 ,)
,)
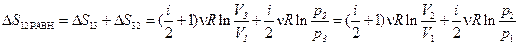 . (2.66)
. (2.66)
Как видно, в расчетную формулу (2.66) входят только параметры начального и конечного состояний.
Если в процессе теплообмена системы с внешними телами происходит нагревание (охлаждение), плавление (кристаллизация) вещества, превращение жидкости в пар (или конденсация), то необходимое для расчета изменение энтропии 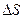 и количество теплоты
и количество теплоты 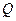 рассчитываются по формулам (2.39), (2.40).
рассчитываются по формулам (2.39), (2.40).
В качестве примера рассмотрим процесс, происходящий в системе за счет теплообмена с внешними телами, процесс нагревания льда массы 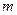 от температуры
от температуры 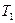 (
(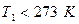 ) до температуры
) до температуры 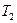 (
( при этой температуре лед превращается в воду). Тогда для расчета изменения энтропии системы мы используем равновесные процессы и рассчитываем
при этой температуре лед превращается в воду). Тогда для расчета изменения энтропии системы мы используем равновесные процессы и рассчитываем 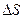 следующим образом:
следующим образом:
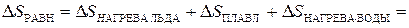
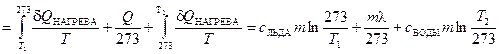 . (2.67)
. (2.67)
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 315; Нарушение авторских прав?; Мы поможем в написании вашей работы!