
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дыхательная недостаточность с преобладанием внелегочных нарушений
|
|
|
|
Дыхательная недостаточность
ДН – это патологическое состояние, при котором аппарат внешнего дыхания не может обеспечить нормальный газообмен и физиологические концентрации газов в крови, либо это достигается благодаря гиперфункции аппарата внешнего дыхания.
I. По скорости возникновения и продолжительности:
- Острая (несколько минут – быстро развивается приступ БА)
- Подострая (в течение недели - гидроторакс)
- Хроническая (месяцы, годы – хроническая обструктивная эмфизема)
II. В клинической практике выделяют следующие формы:
- Гипоксемичекая – ведущая роль принадлежит нарушению перфузии и диффузии.
- Гиперкапничекая – развивается при первичном уменьшении эффективной легочной вентиляции.
- Смешанная – наблюдается при обострении хронических неспецифических заболеваний легких с обструктивным синдромом. ЕЕ развитие обусловлено гиперализованными нарушениями бронхиальной проводимости.
III. По тяжести состояния:
1. Скрытая (бессимптомная) – выявляется при физической нагрузке.
- Компенсаторная.
- Декомпенисрованная – наличие артериальной гипоксемии и/или гиперкаинии.
1. Нарушения центральной регуляции дыхания (инсульт, опухоль, травмы мозга, медикаментозные поражения).
2. Нарушения нервно-мышечной передачи импульса (полиомиелит, миастения, интоксикация).
3. Торакодиафрагмальные нарушения (поражение дыхательной мускулатуры, миалгии, ограничение подвижности грудной клетки – травмы, деформации).
4. нарушения системы кровообращения (левожелудочковая недостаточность, гиповолемия).
5. Анемия
Этот тип ДН возникает первично, лечение в этот период остаются интантными, в последующем вторично поражаются легкие..
Дыхательная недостаточность с преобладанием легочных нарушений.
1. Обструкция центральных и преферических дыхательных путей (инородное тело, ларингоспазм, бронхоспазм, отечно-воспалительный синдром);
2. нарушение растяжимости легочной ткани (эмфизема, интерстициальный отек, пневмоторакс).
3. Утольщение альвеоло-капиллярной мембраны (фиброз, силикоз коллагенозы)
4. Нарушение легочной перфузии (эмболия легочной артерии, васкулиты, легочная гипертензия).
5. Уменьшение объема легочной ткани (резекция легкого, кистозные поражения легких).
В клинической практике имеется сочетание нарушений: при пневмонии ДН развивается вследствие обструктивных, рестриктивных, перфузионных и диффузионных нарушений.
Т.е. ДН может возникнуть в результате:
1. Первичного поражения легких.
2. Вторичного поражения легких.
3. ДН, не связанная с легочным поражением.
IV. Патогенетическая классификация:
1. Вентиляционная (внелегочные причины).
2. Паренхиматозная (поражение легких).
При воздействии этих причин может произойти нарушение вентиляции, перфузии, альвеолокапиллярной диффузии газов.
Вентиляция
В среднем, при каждом выдохе из легких человека удаляется 500 мл. воздуха (DV) и в мин. – 15 дыхательных движений. В этом случае общая вентиляция легких (минутный объем дыхания) составит 500х15=7500 мл/мин.
Однако не весь выдыхаемый воздух достигает альвеолярное пространство. Почему? Потому, что у человека есть анатомически мертвое пространство – это объем проводящих воздухоносных путей (нет легочных капилляров). В норме он составляет – 150 мл, возрастая при глубоком вдохе, т.к. при этом происходит растяжение бронхов паренхимой легкого, (приближенно, у сидящего человека объем мертвого пространства равен в мл массе тела в фунтах (фунт- 1453,6 г), кроме того объем зависит от размеров тела и позы). Поэтому альвеолярная вентиляция составит: (500-150)х15=5250 мл/мин, т.е. это количество выдыхаемого воздуха, а не вдыхаемого. Функциональное (физиологическое) мертвое пространство – объем этих отделов легких, в которых не происходит удаление СО2 из крови (у здоровых - одинаково с анатомическими). У больных с поражением легких ОН отличается от анатомически мертвого пространства в связи с неравномерность кровотока и вентиляции в разных отделах легких. И так физиологическое мертвое пространство состоит из 2х компонентов: анатомического и альвеолярного.
Механизмы нарушения вентиляции
Различают следующие виды расстройства вентиляции:
1. Гиповентиляция.
2. Гипервентиляция.
3. Патологическая неравномерность вентиляции.
Адекватность вентиляции зависит от воздействия легочных и внелегочных фактров.
I. Внелегочные факторы:
1. Состояние центральной регуляции.
2. Активность дыхательных мышц.
3. Подвижность грудной клетки.
II. Легочные факторы:
1. Обструктивные расстройства.
2. Рестриктивные расстройства.
3. Внутрилегочное распределение газов соответственно перфузии.
В основе развития вентиляционной недостаточности лежит 2 механизма:
1. Нарушение биомеханики дыхания
2. Расстройство регуляции системы внешнего дыхания.
Внелегочные факторы
1..Поражение центральной и периферической нервной системы: нарушение мозгового кровообращения, опухоли мозга и отек, метаболические комы, синдром Ундины, синдром обструктивного апноэ во сне у взрослых и младенцев, рассеянный склероз.
2. Поражение дыхательных мышц (масса дыхательных у человека массой 70 кг – 4-5 кг. Возможности дыхательной мускулатуры шире, чем у скелетных мышц).
а) патология центральной импульсации,
б) патология мышц и нервно-мышечного синопса, связано с нарушением передачи в нервно-мышечном синопсе (миастения и синдром Гийена-Барре), судорожным сокращением (столбняк), мышечная дистрофия или атрофия (полиомиелит, голодание атрофия от бездействия), расстройство электролитного баланса (К+, Са++, Mg++), при метаболическом или аспираторном ацидозе и алколозе.
в) усталость измененных дыхательных мышц (при избыточной мышечной работе, недостаточном энергоснабжении, нефизиологическом исходном состоянии мышц).
3. травматические, воспалительные или врожденные поражения диафрагмы (важнейшей инспираторной мышцы).
4. Патология грудной клетки: негерметичность грудной клетки, переломы ребер, регидность грудной клетки и т.д. (ожирение, болевой синдром, напряжение мышц живота при перитоните, беременности).
а) Стабильное обструктивное расстройство в фазу вдоха и фазу выдоха – постоянное сужение ВДП (злокачественные опухоли, пороки развития, последствия травм)
б) лабильное обструктивное расстройство преимущественно выражено в фазе вдоха или выдоха, т.е. м.б. инспираторным и экспираторным
Нарушение проходимости дыхательных путей – важнейший тип патологии вентиляции. Возникает в результате сужения воздухоносных путей и увеличения сопротивления движению воздуха во время вдоха или выдоха.
1. Нарушение механизма естественной очистки дыхательных путей.
2. Обструкция дыхательных путей инородным телом или естественными продуктами организма
3. Отек или воспаление дыхательных путей (лариног – бронхоспазм механического, химического или аллергического генеза).
4. Ранее экспираторное закрытие дыхательных путей (ЭЗДП) возникает как частый механизм ОДН при обструктивной эмфиземе, интеотициальном отеке легких и др. хронических неспецифических заболеваниях легких. Синонимы – «закрытие дыхательных путей», «ловушка» воздуха. У здорового человека ЭЗПД происходит в конце максимального выдоха до уровня остаточного объема легких (т.е. он внешним усилием закрывает собственные дыхательные пути диаметром менее 2 мм.). дыхательные пути закрываются постепенно, вследствие регионарных различий механических своиств легких. Вспомним, что различные зоны легких вентилируются асинхронно, имеют разные градиенты транспульмонального, плеврального и внутрибронхиального давления. Поэтому ЭЗДП в нижних тделах появляется раньше, чем в верхних, в первую очередб закрываются мелкие, затем крупные дыхательные пути. Физиологические механизмы РЭЗДП свидетельствуют, что оно связано с обструктивными и дестриктивными расстройствами. Давление внутри бранхиолы подчиняется закону Бернулли: сумма давлений, направление в доль оси потока и радиально есть величина постоянная. То при увеличении осевого давления в результате сужения бронха или потери эластичности бранхиол или альвеол (эмфизема, пневмосклероз, интерстициальный отек легких) радиальная составляющая недостаточна, чтобы предупредить спадение бронха на выдохе. В зонах с преждевременным закрытием дыхательных путей развивается гипервенитиляция при сохранении кровотока, при этом развивается артериальная гипоксемия т.к. протекающая через эти зоны венозная кровь не может полностью артериализоваться.
Ускорение дыхания снижает радиальную направляющую – РЭЗДП.
Рестриктивные расстройства
Restrictio (лат) – ограничение. Возникает вследствие ограничения расправления легких в фазе вдоха. Иначе - патология податливости (растяжимости) альвеолярной ткани. Снижение растяжимости легких является координальным механизмом при пневмонии ателектазе эмфиземе легких РДСВ.
Рестриктивные расстройства обусловлены:
I. Внелегочные
II. Легочные
1. Потерей эластических волокон легких.
2. Отеком интерстициальной ткани легких. Отек и гиперемия препятствуют нормальному расправлению альвеол.
3. повышенным кровенаполнением
4. Недостатком сурфактанта (РДСВ, РДСН, ателекиаз и др. заболевания) при гипотермии, гипоксии, ацидозе, нарушении кровообращения в малом круге, кислородной терапии.
5. Снижением общей дыхательной поверхности (ателектаз, резекция части легкого).
Сурфактант
Первый шаг в изучении сил поверхностного натяжения в растяжимости легких сделал Нергард: он обнаружил, что легкие наполненные солевым раствором растянуть гораздо легче, чем только воздухом. Затем была изучена стабильность пузырьков пены при отеке легких животных при отравлении ядовитыми газами. Эти два факта способствовали открытию сурфактанта.
Сурфактант – вещество, снижающее силы поверхностного натяжения, вырабатываемое альвеолами II типа, с периодом полураспада в несколько часов, продуцируется на поздних стадиях эмбрионального развития. Имеется на плевре, перикарде, брюшине, глазном яблоке, синовиальных оболочках, участвует в перистальтике ЖКТ, защите его слизистой, в нормальном функционировании слуховых труб. Сурфактант обычно содержит менее 20% белка, основным липидным компонентом его является фосфатидилхолин (70-80% от общего количества липидов), холестерин – меньше 10% массы сурфактанта и дипальмитоловый лецитин. Дипальмитоловый лицетин относится к группе катионных сурфактантов, используемых для создания водоотталкивающих тканей. Синтез сурфактанта происходит внутриэпителиальных клеток, выстилающих альвеолы и альвеолярные ходы – пневмоцитов II типа. Механизм синтеза включает образование пластинок из содержимого матрикса за счет абсорбции липидных мицел, предварительно сформированных в эндоплазматическом ретикулуме. Местом хранения сурфактанта в П-2, одновременно из которого осуществляется его секреция, являются пластинчатые тельца. У человека и др. млекопитающих сурфактант синтезируется путем экзоцитоза. Разрушение и реутилизация сурфактатнта происходит в П-2. Однако в случае: 1. избыточного образования сурфактатнта или 2) при изменении функционального состояния клеток легких, макрофагам принадлежит значительная роль в катаболизме сурфактанта.
Выделенный из легких здоровых животных сурфактант способен изменять 1) уровень секреции альвеолярными макрофагами IL- 1, ФНО, 2) содержание в этих клетках циклических нуклеотидов. Имеются сведения о стимулирующем действии сурфактанта на некоторые функции макрофагов (фагоцитирующую активность, генерирование супероксид-аниона, переваривающую способность, хемотаксис), и наоборот, ингибирующем влиянии на митогенный ответ лимфоцитов крови.
Сурфактантная система легких
Сурфактантная система легких является сложной, многокомпанентной саморегулирующей системой, ответственной за стабильность альвеолярной архитектоники.
Она включает:
1. Сурфактант (альвеолярный и бронхиолярный),
2. Альвеолоциты II типа (возможно, клетки Клара – секреторные нереснитчатые бронхиолярные клетки).
3. Альвеолярные макрофаги.
Сурфактант содержит липиды (с преобладанием фосфолипидов), белки и гликозаминогликаны, т.е. имеет гликолипопротеиноную природу. Изменение соотношения между липидной и протеиновой фракциями приводит к нарушению поверхностной активности. Структурная организация сурфактатнта представлена двумя различным фазами:
1. мономолекулярный слой фосфолипидов (8-10 нм);
2. гипофиза – жидкий комплекс, состоящий из липопротеинов, лепидов и малекул полисахаридов (20-400 нм). В гипофезе расположены решетчатые и мембранные образования сурфактанта, так называемый «тубулярный миелин».
Механизм обновления сурфактанта
1. Основная масса отработанного сурфактанта удаляется альвеолярными макрофагами.
2. Сурфактанта может «дрейфовать» с жидкой гипофазой к бронхиолам, утилизируя из альвеол обломки разрушенных клеток.
3. Элиминация отработанного сурфактанта альвеолоцитами II типа, т.е. осуществляется внутриклеточная рециклизация сурфактанта, как поддержание внутриальвеолярного гемеостаза.
4. мелкие частицы сурфактанта способны проходить через альвеолоциты I типа в интерстициистенки альвеолы в составе пиноцитозных пузырьков.
5. щеточные эпителиоциты с помощью хеморецепторов реагируют на изменение в газовом составе воздуха и гипофазе сурфактанта и вызыват реакцию респираторных отделов.
Механизмы нарушения сурфактантной системы легких
1. Нарушение метаболизма сурфактатнта и повреждение альвеоцитов II порядка.
2. Повреждение сурфактанта.
3. нарушение удаления сурфактатнта.
Тонкая стенка альвеолы (их около 300 млн.) противостоит не тольно давлению вдыхаемого воздуха, но и обладает совершенной системой защиты от проникновения в легкие различных веществ, бактерий, препятствует транссудации жидкости из капилляров. Большинство из этих функций связывают с наличием в легких внеклеточного слоя ПАВ- сурфактанта.
Факторы, вызывающие нарушение функционирования сурфактантной системы
1. хроническая гипоксия, повышение концентрации кислорода, воздействие токсических веществ, кварцевая и асбестовая пыль, этанол, сигаретный дым.
2. длительное воздействие экстримальных факторов внешней среды приводит к перенапряжению сурфактантной системы.
3. злокачественные новообразования вызывают снижение поверхностно-активных свойств сурфактанта.
4. Применение ИВЛ, фторотана.
5. врожденные дефекты сурфактантной системы.
6. При изучениии экспериментального туберкулеза на животных отмечена дезорганизация составных компанентов сурфактантной системы и активации альвеолярный макрофагов, что приводи к разрушению аэрогематического барьера, нарушению проницаемости микрососудов, выходу экссудата и выпадению фибрина в близи очага. Дефицит легочного сурфактанта способствует прогрессированию специфического процесса.
7. при некоторых патологических состояниях возникает «сурфактанторрея», обусловленная дисбалансом в функционировании клеточного звена сурфактантной системы: гиперфункция АЦ-II и недостаточность альвеолярных макрофагов.
Таким образом, состояние клеточных и внеклеточных элементов сурфактантной системы определяет работу легких.
Имеются сведения об участии сурфактанта в модуляции степени выраженности фиброзных изменений легких. В легких, с активно протекающими процессам коллагенообразования, сурфактант теряет супрессивное влияние на лимфоциты, повышает секрецию IL- 1 макрофагами, обладает выраженными ингибирующим воздействием на пролиферацию фибробластов через стимуляцию синтеза простогландинов.
Функции сурфактанта
1. Сурфактант усиливает эластическую тягу легких при максимальных объемах, т.е. делае дыхательный цикл энергетически экономичным.
2. Кроме этого он обеспечивает стабильность и сухость альвеол. [интересно, что не только сурфактант поддерживает стабильность альвеол. В легких существет явление «взаимозависимости», заключающее в наличие противодействия при стремлении одной группы элементов уменьшать или увеличивать объем]. При нарушении питания альвеол, сдвигах метаболизма происходит снижение продукции сурфактанта. Кроме уже названных функций сурфактантная система участвует в антибактериальной, иммуномодулирующей, барьерно-очистительной функйии легких. Его недостаток приводит к отеку легких, ателектазам, образованию пены, РДСН, РДСВ.
Таким образом, обструкция и рестрикция дыхательных путей увеличивает работу дыхательных мышц, которые в уловиях избыточной нагрузки могут забирать половину кислорода легких (в норме потребление О2 дыхательными мышцами составляет менее 5% общего количества кислорода, поглощаемого легкими). Т.е. при ОДН возрастает кислородная цена дыхания.
Нарушение функции газов в легких
Диффузию газов через альвеолокапиллярную мембрану обеспечивает разница парциального давления по обе стороны мембраны. Около 50 лет назад физиологи считали, что в легких происходит секреция кислорода в капилляры, т.е. перемещение против градиента парциального давления, требующий затрат энергии (такой процесс протекает, например в плавательном пузыре рыбы). В легких же человека все газы через альвеолярную стенку переходя путем пассивной диффузии. У взрослого человека общая полщадь альвеолярной поверхности составляет около – 150 м2 (альвеола имеет имеет форму многогранника), капиллярной – 130 м2. кровь находится в капиллярах в течении 0,25-0,75 секунд. Диффузия веществ через ткани описывается законом Фика, согласно которому скорость переноса газа (количество диффундированного газа) через слой ткани прямопропорциональна полщади этого слоя и разнице парциального давления газа по обе стороны и обратно пропорциональна толще слоя. Толщина альвеоло-капиллярного барьера в легких менее 0,5 мкм. Средний диаметр легочных капилляров 7 мкм, т.е. почти равен диаметру эритроцита, т.е. путь диффузии в эритроците длиннее пути через мембрану.
Vr = __ S_ (P1- P2) х D; D = __ d__
D 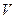 мм
мм
 D = константа диффузии
D = константа диффузии
а – растворимость газа
мм – молекулярная масса
таки образом, мембранное сопротивление связано с 1) толщиной мембраны и 2) свойствами диффундируемого газа. Т.к. растворимость кислорода в ткани мембраны в 20 раз меньше, чем углекислого газа, то кислород диффундирует значительно медленнее, диффузионная способность легких для кислорода (ДЛО2) равна 20 мл/ мин. мм. рт. ст. Поэтому практически мы имеем нарушение процесса диффузии кислорода. Уменьшение диффузионной способности легких для СО2 не приводит к его накоплению в крови. Парциальное давление СО2 в артериальной крови нормовентиляции равно парциальному давлению в альвеолярном газе и равно 40 мм рт. ст. Нарушение DCL сопр. гипоксемией без гиперкаинии. Простейший тест для выявления нарушения – произвольная гипервентиляция.
Процессы, нарушающие альвеоло-капиллярную диффузию
I. Нарушение структуры альвеоло-капиллярной мембраны.
1. Изменение толщины слоев.
а) Утолщение стенки альвеолы.
б) Утолщение стенки капиллрных сосудов. Увеличивается путь для диффузии газов (общая толщина альвеоло-капиллрной мембраны превышает 0,7-0,5 мкм). При этом снижается проницаемость мембран – развивается альвеоло-капиллярный блок.
К этому состоянию могут привести: пневмония, саркоидоз, эмфизема, отек легкого, пневмокониоз, склеродермия.
2. Функциональное состояние альвеоло-капиллярной мембраны.
а) Интерстициальный отек
б) Внутриальвеолярный отек
в) Расширение капиллярных сосудов.
II. Изменение поверхности диффузии, т.е. поверхности функционирующих альвеол, сопровождающихся с функционирующими капиллярами. В норме она составляет ≈ 90 м2.
Снижение
1. Возникает при обширных деструктивных процессах (абсцесс, кавернозный туберкулез).
2. При резекции доли легкого.
3. При снижении поверхности капиллярной сети (эмфизема, васкулит легочной артерии)
4. при ателектазе – полное прекращение вентиляции легочных альвеол.
III. при измененной характеристике тканей на пути диффузии (толщина мембраны не изменяется) – беррилиоз мембраны.
Основным клиническим проявлением диффузионной способности легких является артериальная гипоксемия.
Основные причины расстройства легочного кровотока
Малый круг кровообращения представляет собой контур большого Т с низким сопротивлением функционально расположенный м/д правой и левой половинами и должен вмещать весь V сердечного выброса как в состоянии покоя так и при напряжении.
Вспомним, что в легких существует 2 системы кровообращения: бронхиальный кровоток (кровоток в бронхиальной системе гараздо меньше, чем в легочных, поэтому после пересадки легких они могут функционировать без них) и легочный кровоток (малый круг кровообращения, существенно отличающийся от большого – он лишен тонких механизмов ауторегуляции кровяного давления).
Главным регулирующим механизмом легочного кровотока является легочное сосудистое сопротивление, а движущей силой легочного кровотока – различие давлений в правом желудочке и левом предсердии. Вспомним, что давление в легочных сосудах очень низкое, в легочном стволе ≈ 15 мм рт. ст. (для сравнения в аорте ≈ 100 мм рт. ст.), стенки тонкие, содержат немного гладко-мышечных волокон. Легочное венозное даволение и сосудистое сопротивление примерно в 10 раз ниже, чем в большом круге и требуется пятикратное увеличение объема крови в легких, чтобы легочное артериальное давление несколько возрасло. Главная функция легочного кровообращения - постоянное омывание кровью альвеоло-капиллярного барьера с целью газообмена. Другая функция: резервуар крови, фильтрация крови.
Нарушение легочного кровотока
1. Нарушение сократительной способности правого и левого желудочков, ведущее к нарушению общей перфузии легких.
2. Некоторые врожденные и приобретенные пороки сердца (стеноз правого предсердно-желудочкового отверстия, стеноз легочного ствола и др.).
3. Острая сосудистая недостаточность.
Первые 3 большие группы причин ведут к нарушению общего кровотока легких, а именно, снижение кровотока, преобладание вентиляции над перфузией, возникает кислородное голодание тканей, за счет снижения МОК до 3 л/мин. вместо 4,5-5 л/мин в норме.
4. патологические процессы, ведущие к ишемии легкого – легочные васкулиты (болезнь Шенлейн-Геноха, артериит Такаясу).
5. Макро- и микроэмболии тромботическими массами, газом, жиром. Механизм воздействия в данном случае зависит от характера эмболии – вплоть до ишемии легкого. Возможно, рефлекторное воздействие на бронхи, сосуды. Воздействие БАВ, выделяющихся из эмболов.
6. легочная артериальная гипертензия первичная или приобретенная. Одной из причин легочной артериальной гипертензии является гипоксия, в основе гипоксической вазоконстрикции лежит рефлекс Эйлера-Лилиестранда: при снижении парциального давления О2 в крови легочные сосуды спазмируются (в нормальных условиях это приводит к тому, чтоневентилируемые альвеолы не перфузируются).В условия патологии при утрате этого механизма невентилируемые альвеолы продолжают перфузироваться, что ведет к возникновению патологического венозного шунта. Сам эйлер, однако, не считал этот механизм всеобъемлющим, (большое значение ему придают экспериментаторы, наблюдающие повышение систолического давления в легочной артерии при объединении дыхательной системы кислородом).
6. Физиологические механизмы ДН, относящиеся к нарушениям легочного кровотока редко бывают изолированными, чаще наблюдается нарушение вентилляционно-перфузионных отношений. От величины вентилляционно-перфузионного соотношения зависит эффективность легких как газо-обменного прибора.
В легких в норме и в патологии имеются 3 типа альвеол.
1. Альвеолы, составляющие эффективный альвеолярный объем оптимально вентилируемые и перфузируемые. При этом давление в легочных артериях ниже альвеолярного. В данной области величина кровотока определяется разницей между артериальным и альвеолярным давлением. Венозное давление не влияет на кровоток, пока не становится выше альвеолярного.
2. Альвеолярное мертвое пространство –вентилируемые, но не перфузионные альвеолы. Как правило, такая ситуация в норме не наблюдается, т.к. в легочных артериях достаточно, чтобы поднять кровь.
3. альвеолярный вено-артериальный шунт перфузируемые, но не вентилируемые. Здесь давление в легочных венах выше альвеолярного и величина кровотока как в обычных сосудах определяется разницей между артериальным и венозным давлением.
Для оптимального газообмена в легких необходимо поддерживание отношения альвеолярной вентиляции (4 л) к минутному объему крови (5 л) в пределах 0,8-1. Но в верхних отделах легких этот коэффициент равен 3,3 за счет преобладания кровотока.
В условиях патологии (эмфизема, ателектаза, пневмония) присоединяется патологическая неравномерность вентиляции, обусловленная вовлечением в процесс кровеносных сосудов, вызываемая неравномерность кровотока в капиллярных сосудах. Расстройства прохождения воздуха в дыхательных путях и нарушение эластичности легких также приведут к неравномерности вентиляции.
Эффективность легочного кровотока зависит от: V
4 Q
Va = _____ = 0.8
Q 5
Va – величина альвеолярной вентиляции
Q – величина легочного кровотока
β– нора от 0,8 до 1,0
Нарушение данного отношения проявляется следующими эффектами:
1. Эффект мертвого пространства – локальное преобладание вентиляции над кровотоком.
2. Эффекто вено-артериального легочного шунтирования – преобладание кровотока над вентиляцией.
Как лбъяснить, что насышение артериальной крови кислородом Sа О2 = 97,1%, а не 100%. Как раз наличием вено-артериального легочного шунтирования и в меньшей мере неполной диффузией кислорода В норме шунтами являются бронхиальные артерии и еще естественным шунтом являются Тебезиевы вены. При патологическом шунте – в кровь, оттекающую от легочных капилляров, поступает смешанная венозная кровь из легочных артерий.
Нарушения вентиляционно-перфузионных отношений определяются:
1. Увеличение альвеолярного и анатомического мертвых пространств.
2. Степенью снижения эффективного альвеолярного объема.
3. Увеличение % альвеолярного веноартериального шунта.
Таким образом, газовый состав крови, оттекающей от легких, формируется в результате эффективности взаимодействия анатомического мертвого пространтсва, альвеолярного эффективного объема, альвеолярного мертвого пространства и альвеолярного артерио-венозного шунта.
Методы изменения диффузионной способности легких
Так как перенос кислорода в кровь легочных капилляров ограничен скоростью легочного кровотока (м.б. и диффузия), то для измерения диффузионной способности легких используют окись углерода.
V= _ S __ (P1- P2) х D и Р2 – парциальное давление в СО в альв. возд. и
d капиллярной крови
DL = __ V co _ = __ V co ____
P1 – P2 Pa co
1. Метод одиночного вдоха – обследуемый вдыхает смесь газов 1 раз и задерживает дыхание на 10 сек. Рассчитывают скорость вымывания СО из альвеолярного воздуха за это время.
2. равновесный метод – обследуемый дышит газовой смесью с низкой концентрацией СО (≈ 0,1%) до установления равновесия
методы функциональной оценки обструктивных вентиляционных нарушений
1. тест Тиффо - ___ ОФВ за 1 сек __ х 100% В норме 65-70 % и
ЖЕЛ умер. нар. 55-64%
выраж. 40-54 %
тяж. обостр. < 40%
2. Определение показателей кривой поток- объем максимального выдоха, т.е. изменение объемной скорости максимального выдоха в динамике. С помощью этого теста можно определить уровень обструкции бронхов.
Методы оценки рестриктивных нарушений
Рестриктивные нарушения определяют изменения объемных показателей дыхания: снижение ЖЕЛ, МВЛ, повышение ЧД (частоты дыхания).
РДСВ
Среди многих форм ОДН (астматический статус, острая легочная эмболия и т. д.) наименее изученными является РДСВ- синдром- одна из наиболее тяжелых форм ОДН.
Респираторный дистресс- синдром взрослых (РДСВ)- описательный термин, обозначающий ОДН на фоне диффузных инфильтративных изменений в легких различной этиологии. Синдром описан Эсбахом и соавт. в 1967 году,и назван по аналогии с ранее известным дистресс- синдромом новорожденных, когда существует врожденный дефицит сурфактанта. При РДСВ недостаток сурфактанта вторичен. Distress в переводе с английского означает тяжелое нарушение функции, патологическое состояние. Среди всех синонимов РДСВ- «шоковое легкое», «влажное легкое», «постперфузиозный легочный синдром», наиболее удачным является термин «некардиогенный отек легких», который указывает на патогенетические различия между классическим кардиогенным отеком легких и РДСВ.
Вероятность развития синдрома возрастает при наличии нескольких этиологических факторов и летальность составляет (60-70%), наиболее высока при сепсисе, осложненном шоком (летальность при этом достигает 90%). (Смерть большинства больных с РДСВ может быть признаком нераспознанной инфекции и полиорганной недостаточности в основе с дыхательными нарушениями).
Из определения РДСВ следует, что это своеобразная форма острой дыхательной недостаточности, при которой развивается артериальная гипоксемия в результате ряда тяжелых состояний с первичным поражением альвеоло- капиллярной мембраны, и развитием интерстиционального отека легких. В основе нарушенного газообмена лежит нарушение диффузии газов и шунтирование венозной крови в артериальное русло.
Существуют 4 главных критерия ОДН:
1. Диспноз
2. Парциональное давление кислорода (РаО2) при дыхании воздухом менее 50 ии. рт. ст..
3. Парциальное давление углекислоты (РаСО2) более 50 мм. рт. ст..
4. рН артериальной крови ниже 7,3.
4 главных патофизиологических механизма ОДН:
1. Нарушение диффузии О2 СО2.
2. Шунтирование венозной крови в артериальное русло.
3. Гиповентиляция альвеол.
4. Нарушения соответствия между вентиляцией и перфузией.
У больных РДСВ вовлечены все четыре механизма. Но главными считаются диффузионные и шунтовые нарушения.
Причины развития этого состояния разнообразны. Повреждение легких может быть проявлением как прямого (аспирация. Ингаляция токсических веществ), так и не прямого воздействия на легкие (шок, любой этиологии, сепсис, политравма, кровопотеря и т.д.). В одних случаях повреждение легких репарируется быстро (возвращается к N за несколько дней, в других_ возникает устойчивая воспалительная реакция, выздоровление идет медленно (нед., месяцы) или не наступает вовсе).
Этиологические факторы РДСВ синдрома.
Несмотря на то, что РДСВ первично был описан как осложнение травматических состояний (при торокальной травме в 1945 г.) на первом месте по риску возникновений стоят септические состояния и септицемия. Травматические состояния на втором месте.
1. Инфекции:
внелегочные – сепсис - развивается системн. восп. р-я с острым повреждением эндотелие во всем организме, включая легкие;
легочные – вирусные, бактериальные, грибковые.
2. Шок:
Анафилоктический, септический, постгеморрагический.
3. Аспирация в легкие рвотных масс, воды.
4. Метоболические нарушения:
диабетический кетоацитоз, уремия.
5. Эмболия легочной артерии различного происхождения:
Жировая, воздушная, амниотической жидкостью.
6. Гематологические нарушения:
ДСВ - синдром, массивные гемотрансфузии, постперфузионные гемотрансфузии (после АИК), тромбоцитопенические пурпура.
7. Нейрогенные причины:
геморрагические инсульты, отек мозга.
7а. Синдром реимплантации – у реципиентов легочного трансплантата
(если легкое было повреждено во время пересадки).
8. Лекарственные воздействия:
аспирин, барбитураты, фуродонин, героин.
9. Вдыхание раздрожающих токсических веществ:
«чистый» кислород, озон, хлор, аммиак, окислы азота.
10. Прочие причины:
острый панкреатит, аутоиммунные заболевания (СКВ, синдром Гудпасчера), злокачественная малярия, акушерская патология, высотный отек легких.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1369; Нарушение авторских прав?; Мы поможем в написании вашей работы!