
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катализ
|
|
|
|
Катализ – изменение скорости химической реакции при воздействии некоторых веществ. Вещества, ускоряющие протекание химической реакции, называются катализаторами, а вещества, замедляющие химическую реакцию,− ингибиторами. Поэтому различают положительный и отрицательный катализ. Каталитических процессов, реализуемых в природе и технике, очень много: реакции, протекающие в живых организмах (ферментативные процессы), переработка нефти с помощью крекинга и риформинга, гидролиз сложных эфиров, получение серной кислоты и т.д.
Катализатор – вещество, вступающее в промежуточное взаимодействие с реагирующими веществами, но не входящее в состав продуктов, т.е. количественный и качественный его состав не меняется в результате реакции. Так как катализатор не входит в состав исходных веществ и продуктов реакции, то он не может оказывать влияния на ∆ rG 0 T, являющейся функцией состояния. Следовательно, он ускоряет только термодинамически возможные реакции и не может вызвать протекание тех реакций, для которых ∆ rG 0 T > 0.
Катализаторы подразделяются на:
1. Гомогенные – катализатор и реагенты находятся в одной фазе
2SO2 (г) + O2 (г)  2SO3
2SO3
2. Гетерогенные – катализатор образует отдельную фазу от реагентов
2SO2 (г) + O2 (г)  2SO3
2SO3
Основной причиной возрастания скорости реакции в результате положительного катализа является значительное понижение энергии активации реакции. Наиболее важное практическое значение имеет гетерогенный катализ, хотя гомогенные катализаторы эффективнее гетерогенных.
Скорость гомогенных каталитических реакций пропорциональна концентрации катализатора. Несмотря на большое многообразие механизмов подобных реакций, их можно свести к двум схемам:
I. Слитный механизм –катализатор взаимодействует с реагентами с образованием интермедиата (промежуточного соединения), который распадается с образованием продуктов реакции и регенерируется катализатор.
Энергетическая диаграмма гомогенной каталитической реакции, схема которой
А + В + Kat ⇄ ABKat≠→ AB + Kat,
имеет следующий вид

II. Стадийный механизм – реагенты последовательно взаимодействуют с катализатором
А + Kat ⇄ AKat≠→ AKat,
AKat + В ⇄ AKatВ≠→ AB + Kat.
Для данного случая энергетическая диаграмма:
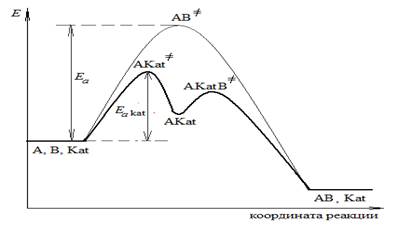
В случае гетерогенного катализа реакция протекает на границе раздела фаз. Поэтому, активность катализатора зависит от размера и состояния его поверхности: чем сильнее развита поверхность (больше число мелких пор), тем эффективнее действие катализатора. В противоположность гомогенным каталитическим реакциям, скорости гетерогенных процессов зависят не от объемных концентраций, а от поверхностных концентраций.
Согласно определению, катализатор остается химически неизменным после завершения реакции. Однако, при гетерогенном катализе, обычно протекающем при высоких температурах, неизбежно изменяется физическое состояние катализатора, прежде всего микроструктура его поверхности.
Гетерогенные каталитические процессы включают в себя следующие стадии:
1) Диффузия реагентов к поверхности катализатора (внешняя диффузия)
2) Диффузия реагентов в поры катализатора (внутренняя диффузия)
3) Адсорбция реагентов в порах катализатора
4) Химическая реакция, которая может протекать в несколько стадий
5) Десорбция продуктов с поверхности катализатора
6) Диффузия продуктов реакции в порах катализатора к внешней поверхности его гранул
7) Диффузия продуктов от внешней поверхности катализатора
В гетерогенном катализе значительную роль играет адсорбция, поэтому на энергетической диаграмме, как правило, не показывают стадии диффузии. Процесс адсорбции является экзотермическим процессом (∆ H < 0), а процесс десорбции – эндотермическим (∆ H > 0; для того, чтобы «оторвать» продукты от поверхности катализатора, надо затратить энергию).
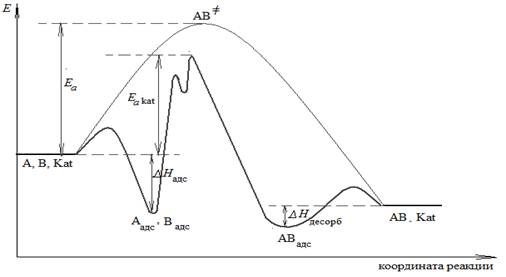
Адсорбция – самопроизвольный процесс концентрирования вещества на поверхности раздела фаз. Твердое вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а адсорбирующееся вещество,− адсорбатом. В данном случае адсорбентом является катализатор, а адсорбатами – реагирующие вещества.
Различают следующие виды адсорбции:
1. Физическая – протекает даже при низких температурах вследствие сил межмолекулярного взаимодействия. Энергии при физической адсорбции выделяется мало и адсорбируемое вещество не меняет строения.
2. Химическая (хемосорбция) представляет собой поверхностную химическую реакцию, т.е. между молекулами адсорбата и адсорбента возникает химическая связь. Образующиеся при этом соединения обладают высокой реакционной способностью и участвуют в последующих стадиях гетерогенного катализа. Хемосорбция, в отличие от физической адсорбции, протекает при более высокой температуре и сопровождается большим выделением энергии.
Основой количественного рассмотрения процесса хемосорбции является теория Лэнгмюра. Ее основные положения:
1) На поверхности адсорбента существует ограниченное число адсорбционных центров
2) Все адсорбционные центры одинаковы
3) На каждом адсорбционном центре может адсорбироваться только одна молекула
4) Молекулы, адсорбированные на соседних центрах, не влияют друг на друга, т.е. силами притяжения и отталкивания между ними можно пренебречь
5) Адсорбируемые молекулы находятся в динамическом равновесии с молекулами, находящимися в объеме.
При равновесии скорость адсорбции равна скорости десорбции
r адс = r десорб .
Чтобы молекула адсорбировалась, она должна удариться о поверхность и попасть в незанятое место. Так как число ударов пропорционально концентрации, а вероятность попасть на незанятое место пропорционально их числу, то скорость адсорбции
r адс = k адс · С· (1 – θ),
где θ = 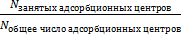 – доля занятых адсорбционных мест (степень заполнения адсорбента)
– доля занятых адсорбционных мест (степень заполнения адсорбента)
(1 – θ) – доля незанятых адсорбционных мест
Молекула десорбируется, когда ее энергия окажется достаточной для того, чтобы оторваться от поверхности. Число таких молекул будет пропорционально числу адсорбированных молекул, поэтому скорость десорбции
r десорб = k десорб · θ.
Таким образом, при равновесии
k адс · С· (1 – θ) = k десорб · θ,
θ = 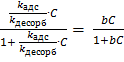 .
.
Это уравнение отвечает изотерме Лэнгмюра для одного компонента, которая представляет собой гиперболу

Если bC << 1, то θ ≈ bC и по тангенсу угла наклона касательной к начальному участку прямой можно найти занятых адсорбционных мест. Однако во многих случаях реальные изотермы не описываются уравнением Лэнгмюра, причиной чему являются энергетические неоднородности поверхности реальных катализаторов.
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 2475; Нарушение авторских прав?; Мы поможем в написании вашей работы!