КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы. Уравнение Ван-дер-Ваальса
|
|
|
|
АГРЕГАТНЫЕ СОСТОЯНИЯ И ФАЗОВЫЙ ПЕРЕХОД
Поведение реальных газов довольно хорошо описывается уравнением Менделеева-Клайперона, т.е. уравнением состояния идеального газа:
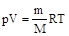 , (9.1)
, (9.1)
только при не слишком высоких давлениях и достаточно высоких температурах.
С повышением давления и уменьшением температуры наблюдается значительное отступление от этого уравнения, т.е. с повышением давления поведение реальных газов отклоняется от поведения газов идеальных. Например, рассмотрим произведение pV для массы азота, занимающей при нормальных условиях объем, равный одному литру. В соответствии с уравнением (9.1) pV при неизменной температуре должно оставаться постоянным. В действительности, как видно из таблицы, при повышении давления наблюдаются заметные отклонения от постоянства pV, которые достигают 100% при Р=1000 атм.
| Р, атм | pV, атм×V |
| 1,000 | |
| 1,390 | |
| 2,069 |
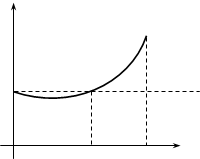
Графическая зависимость произведения давления на объем реального газа при увеличении давления для кислорода представлена на рис.9.1. Для идеального газа подобная зависимость выражается прямой линией, параллельной оси абсцисс.
рV
идеальный газ
400 1000 р, ат
Рис.9.1
| Рассматривая график, мы видим, что реальный газ при увеличении давления перво-начально сжимается больше, чем это следует из уравнения идеальных газов, так что произведение pV уменьша-ется с возрастанием давления. При дальнейшем увеличении давления начинают сказы-ваться какие-то иные свойства молекул реальных газов, в силу которых произведение |
pV возрастает. Причины подобных отклонений заключаются в следующем:
1) большую сжимаемость реального газа по сравнению с идеальным газом обуславливают силы межмолекулярного взаимодействия; молекулярное сцепление приводит к возникновению как бы добавочного давления, возрастающего при увеличении плотности газа;
2) наблюдаемое при высоких давлениях уменьшение сжимаемости и соответствующее возрастание произведения pV объясняется тем, что реальные молекулы не являются материальными точками, а обладают некоторым конечным объемом.
По мере увеличения давления возрастает плотность газа, а вместе с ней возрастает влияние собственного объема молекул – газ оказывает большее сопротивление сжатию, чем это следует из уравнения Клайперона.
Уравнение состояния реального газа было предложено впервые голландским физиком Ван-дер-Ваальсом (1837-1929) и носит его имя. Уравнение Ван-дер-Ваальса отличается от уравнения Клайперона наличием двух поправочных членов, один из которых учитывает влияние собственного объема молекул, а другой – влияние сил молекулярного притяжения.
Рассмотрим подробнее каждый из этих поправочных членов.
Рассчитаем поправку на недоступный объем. Молекула идеального газа, заключенная в некотором сосуде, может находиться в любой его точке и для нее доступен весь объем сосуда V.
Молекула реального газа не может находиться в тех местах сосуда, где расположены остальные (N-1)-молекул и ей доступна лишь часть всего объема, равная (V-b), где b - объем, недоступный для молекул. Для подсчета этого недоступного объема будем считать, что в газе происходят только двойные соударения молекул. Для каждой пары взаимодействующих молекул недоступной является та часть объема, в которой расстояние между их центрами равно d, где d - диаметр молекулы, т.е. сфера с объемом 4/3pd3. Из N-молекул может быть образовано 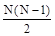 пар. Следовательно, полный недоступный объем для всех молекул равен
пар. Следовательно, полный недоступный объем для всех молекул равен
 .
.
На каждую из N -молекул приходится
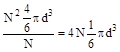 , т.е.
, т.е. 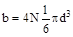 .
.
С учетом введенной поправки уравнение состояния реального газа примет вид
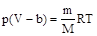
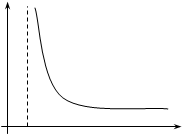
при T=const p(V-b)=const.
График этой зависимости изображен на рис.9.2
p
b V Рис.9.2 | Изотермы p(V-b)=const имеют вид гипербол, у которых давление безгранично возрас-тает при V®b. Рассчитаем поправку на «внутреннее давление» (точнее на влияние сил межмоле-кулярного притяжения). Сила давления газа на стенку сосуда – есть результат многочислен ных столкновений молекул с |
твердой поверхностью. Поэтому давление идеального газа прямо пропорционально концентрации молекул n в слое, прилежащем непосредственно к стенке:
n = N/V.
Так как между молекулами газа действуют силы притяжения, то давление уменьшается на величину p¢. Поскольку силы взаимодействия очень быстро убывают с расстоянием, то практически следует учитывать притяжение первого слоя лишь одним соседним слоем II (рис.9.3). Сила этого притяжения, рассчитанная на единицу площади, пропорциональна концентрации молекул в обоих слоях:
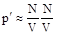 .
.
Обозначим коэффициент пропорциональности a, тогда
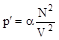 .
Обозначим aN2= a, тогда p¢= a /V2. Вид коэффициента a зависит от конкретного строения взаимодействующих молекул, т.е. от природы газа. Объединяя вторую поправку с первой, мы можем записать .
Обозначим aN2= a, тогда p¢= a /V2. Вид коэффициента a зависит от конкретного строения взаимодействующих молекул, т.е. от природы газа. Объединяя вторую поправку с первой, мы можем записать
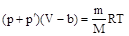 или
или
|  I II
Рис.9.3
I II
Рис.9.3
|
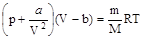 - уравнение Ван-дер-Ваальса.
- уравнение Ван-дер-Ваальса.
В этом уравнении V - объем, занимаемый m -граммами газа. Поскольку при выводе уравнения был сделан целый ряд упрощений, на него следует смотреть как на приближенное уравнение состояния реального газа.
Вычисленные с помощью уравнения Ван-дер-Ваальса значения давления газа, достаточно точно совпадает с опытом лишь при относительно высоких температурах и только в некотором интервале давлений.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 920; Нарушение авторских прав?; Мы поможем в написании вашей работы!