
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальные изотермы. Критические состояния
|
|
|
|
Уравнение Ван-дер-Ваальса – алгебраическое уравнение третьей степени относительно объема. Для одного моля газа
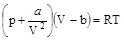 .
.
Раскрыв скобки и расположив члены уравнения по убывающим степеням объема, можно записать последнее в следующем виде:
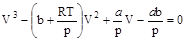 . (9.1)
. (9.1)
Это уравнение третьей степени относительно объема и, следовательно, при данных р и Т оно может иметь или три вещественных корня, или один вещественный и два комплексно-сопряженных корня, не имеющих физического смысла. Это зависит от соотношения между коэффициентами. При низких температурах уравнение имеет три вещественных корня и график p=f(V) имеет вид, изображенный на рис.9.4.
 р
рнп
жид-
кость жидкость +
газ газ
V1 V2 V3 V
Рис.9.4 р
рнп
жид-
кость жидкость +
газ газ
V1 V2 V3 V
Рис.9.4
| Для того, чтобы полу-чить изотерму опытным путем, нужно взять вещест-во в газообразном состоя-нии, поместить его в сосуд с перемещающимся порш-нем и начать медленно сжимать, делая одновре-менно отсчеты давления и объема, а также, следя за тем, чтобы температура вещества оставалась посто-янной. Результат подоб-ного опыта дан на рис.9.4 (жирная линия). |
Вначале с уменьшением объема давление газа растет, причем ход изотермы хорошо описывается уравнением Ван-дер-Ваальса (9.1).
Однако, начиная с некоторого объема V3, экспериментальная изотерма перестает следовать уравнению (9.1). Начиная с этого значения объема, давление в сосуде перестает изменяться, само вещество перестает быть однородным, часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы: жидкую и газообразную.
По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении, обозначенном на рисунке рнп. После того, как процесс конденсации вещества в жидкость заканчивается при V=V1, дальнейшее уменьшение объема сопровождается быстрым ростом давления. При этом ход изотермы снова примерно следует уравнению (9.1). Вещество в состояниях, соответствующих этому участку изотермы, снова будет однородным, но представляет собой не газ, а жидкость.
Таким образом, уравнение Ван-дер-Ваальса описывает не только газообразное состояние вещества, но охватывает также процесс перехода в жидкое состояние и процесс сжатия жидкости.
Сопоставление экспериментальной изотермы с изотермой Ван-дер-Ваальса дает, что эти изотермы довольно хорошо совпадают на участках, отвечающих однофазным состояниям вещества, но ведут себя совершенно различным образом в области расслоения на две фазы. Вместо S-образного завитка на изотерме Ван-дер-Ваальса экспериментальная изотерма имеет в этой области прямолинейный горизонтальный участок.
В состояниях, соответствующих горизонтальному участку изотермы, наблюдается равновесие между жидкой и газообразной фазами вещества. Газ, находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление рнп, при котором может существовать равновесие при данной температуре, называется давлением насыщенного пара.
Опыт показывает, что с повышением температуры (T¢<T¢¢<T¢¢¢<Tк) горизонтальный участок изотермы сокращается и при некоторой температуре он стягивается в точку. Называется эта температура критической (рис.9.5). При этом уменьшается различие в удельных объемах, а следовательно, и в плотностях жидкости и насыщенного пара.
рнп
р¢¢¢нп Тк р¢¢нп Т¢¢¢ Т¢¢ р¢нп Т¢
Рис.9.5 | 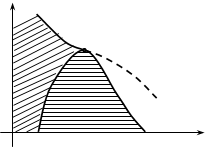 р
К
Ж
Ж+П
П
V
Рис.9.6
р
К
Ж
Ж+П
П
V
Рис.9.6
|
При критической температуре это различие исчезает. Одновременно исчезает всякое различие между жидкостью и паром. Если провести линию через крайние точки горизонтальных участков изотерм, получается колокообразная кривая, ограничивающая область двухфазных состояний вещества. Колокообразная кривая и участок критической изотермы, лежащий слева от точки К делит диаграммы(pV) на три области (рис.9.6).
Наклонной штриховкой помечена область однородных жидких состояний. Под колокообразной кривой располагается область двухфазных состояний и область, лежащая справа от колокообразной кривой и верхней ветви критической изотермы, представляет собой область однородных газообразных состояний вещества. Особо следует отметить область, лежащую под правой ветвью критической изотермы – область пара.
Состояние вещества в этой области отличается от остальных газообразных состояний в том отношении, что при изотермическом сжатии вещество, находящееся в этом состоянии, претерпевает процесс сжижения. Вещество, находящееся в газообразном состоянии при температуре выше критической, не может быть сжижено никаким сжатием.
ркр К
p¢¢нс Т¢¢¢
Тк p¢нп Т¢¢ Т¢
V1 V2 V3 Рис.9.7 | Рассмотрим изотермы Ван-дер-Ваальса для нескольких значений температуры (рис.9.7). Расчеты показывают, что при температуре T¢ коэффициенты в уравнении (9.1) таковы, что все три решения уравнения оказыва-ются вещественными. С повы-шением температуры различие между тремя вещественными решениями уравнения (9.1) уменьшаются. Начиная с опре-деленной, своей для каждого ве- щества, температуры Ткр, при |
любом давлении вещественным остается только одно решение, соответствующее точке К. Температура называется критической температурой. Точка К называется критической точкой. Для соответствующей изотермы точка К служит точкой перегиба. Ей соответствуют три совпадающих вещественных решения уравнения (9.1). Касательная к критической изотерме в точке К является пределом, к которому стремятся секущие p¢ и p¢¢ при приближении температуры к критической. Следовательно, эта касательная, как и все секущие параллельна оси V так, что производная 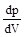 в точке К равна нулю.
в точке К равна нулю.
Кроме того, в точке перегиба должна быть равна нулю и вторая производная 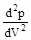 . Разрешим уравнение (9.1) относительно
. Разрешим уравнение (9.1) относительно
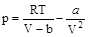 . (9.2)
. (9.2)
Дифференцирование этого выражения по V дает
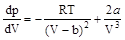 ;
;
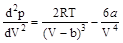 .
.
В критической точке при Т=Ткр и V=Vкр эти выражения обращаются в ноль:
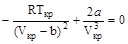 ;
;
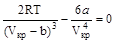 .
.
Соответствующие значения и ркр носят название критического объема и критического давления для данного вещества. Из уравнения (9.2) находим
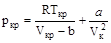 .
.
Решая систему трех уравнений с тремя неизвестными Vкр, pкр и Ткр, получим
Vкр = 3b;
pкр =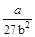 ;
;
Ткр =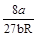 .
.
Таким образом, зная константы Ван-дер-Ваальса a и b, можно найти соответствующие критической точке Vкр, pкр и Ткр, которые называют критическими величинами. И наоборот, по известным критическим величинам могут быть найдены значения констант Ван-дер-Ваальса.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 542; Нарушение авторских прав?; Мы поможем в написании вашей работы!

 К
К