
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие об энергии активации
|
|
|
|
Зависимость скорости реакции от концентрации реагирующих веществ.
Важнейшими факторами, определяющими скорость химической реакции, являются: концентрация реагирующих веществ, характер среды, температура, катализатор, для газовых реакций – давление.
Согласно основному закону химической кинетики, закону действия масс (Гульдберг и Вааге, 1867 г.), скорость химической реакции, протекающей в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. Например, для реакции:
aА + bB 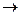 cC + dD V = kl[А]a[B]b
cC + dD V = kl[А]a[B]b
где k – константа скорости химической реакции, постоянная, зависящая от природы реагирующих веществ и температуры процесса.
Скорость гетерогенных реакций зависит от площади поверхности раздела фаз. Например, для реакций:
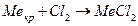
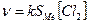
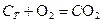
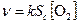
концентрации твердых веществ считают практически постоянными, они входят в константу скорости.
Чтобы произошла химическая реакция между частицами системы (атомами, ионами, молекулами), необходимо их столкновение.
Но не каждое столкновение частиц приводит к взаимодействию: оно имеет место лишь в случае, когда частицы сближаются на такое расстояние, при котором происходит перекрывание их электронных облаков, а, следовательно, и перераспределение их электронной плотности; при этом одни связи разрушаются, а другие – образуются.
Для такого взаимодействия частицы должны обладать определенным избытком
энергии (по сравнению со средней величиной энергии всех частиц), т.е. быть активными.
Избыточная энергия, которой должны обладать молекулы для того, чтобы при их столкновении могла произойти реакция, называется энергией активации. Она является основным фактором, определяющим скорость той или иной реакции: чем меньше энергия активации, тем быстрее при данной температуре будет протекать процесс.
Как следует из рис.1, в процессе химической реакции (I) аА + bB <=> cC + dD (II) система взаимодействующих частиц претерпевает энергетические изменения: ее энергия возрастает из исходного состояния (I), проходит через максимум (с точкой А) – «энергетический барьер», соответствующий переходному состоянию (его называют активированным комплексом), после чего быстро снижается и образует конечные продукты (II).
При этом разность между энергией переходного состояния (А) и энергией исходных веществ (I) есть энергия активации прямой реакции Е'ª, а разность между энергией переходного состояния (А) и энергией конечных продуктов (II) есть энергия активации обратной реакции Е''ª.
Разность энергий исходных веществ (I) и продуктов реакции (II) определяет теплоту реакции (ΔН). Реакции, протекающие с выделением тепла, называются экзотермическими. Реакции, протекающие с поглощением тепла, называются эндотермическими.
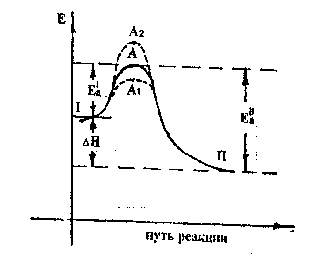 |
Рис.1 Изменение потенциальной энергии системы при осуществлении химической реакции.
Энергетические барьеры ограничивают протекание реакций. Благодаря этому, многие в принципе возможные реакции (при (ΔG<O) задерживаются или практически не протекают. Так, дерево, бумага, уголь, нефть способны окисляться и гореть в воздухе, но в обычных условиях (при невысоких температурах) они не загораются сами собой, так как высока энергия активации соответствующих реакций.
Все внешние условия, например катализаторы, уменьшающие значение энергии активации системы, увеличивают скорость химической реакции.
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 680; Нарушение авторских прав?; Мы поможем в написании вашей работы!