
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катализ
|
|
|
|
Зависимость скорости реакции от температуры.
При повышении температуры скорость реакции увеличивается, так как при этом резко возрастает число активных молекул вследствие перераспределения тепловой энергии между молекулами.
В соответствии с эмпирическим правилом Вант-Гоффа при повышении температуры на каждые 10оС скорость реакции увеличивается в 2-4 раза.
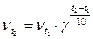
 ,
,
где 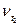 и
и 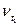 - скорости реакции при температуре
- скорости реакции при температуре 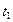 и
и  ;
;
g – температурный коэффициент реакции.
g = 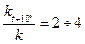
Скорость реакции возрастает с повышением температуры по экспоненциальному закону, и более точно, чем по правилу Вант-Гоффа. Зависимость константы скорости от температуры описывается уравнением Аррениуса: k = koe –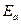 /RT или lnk = lnko - Ea/RT, где ko – постоянный множитель, зависящий от общего числа столкновений и строения молекул. При увеличении Т константа скорости растет и тем сильнее, чем больше становится число активных частиц и чем меньше значение энергии активации (Еа).
/RT или lnk = lnko - Ea/RT, где ko – постоянный множитель, зависящий от общего числа столкновений и строения молекул. При увеличении Т константа скорости растет и тем сильнее, чем больше становится число активных частиц и чем меньше значение энергии активации (Еа).
Увеличение скорости каталитической реакции связано с уменьшением энергии переходного состояния системы (точка АI на рис.1), вследствие чего через определенный промежуток времени через переходное состояние пройдет большее число частиц и, следовательно, скорость реакции в присутствии катализатора будет высокой. Согласно теории Н.Д. Зелинского и П. Сабатье, при гомогенном катализе катализатор образует с реагирующими веществами промежуточные соединения, причем разложение последнего является лимитирующей стадией. Это и приводит к уменьшению энергии активации реакции.
Например, реакция
А + В → А … В → А В
активированный
комплекс
в присутствии катализатора K может проходить по схеме:
А + K → А … K → А K
активированный
комплекс
B + AK → B … AK → АB + K,
активированный
комплекс
суммируя два последних уравнения, получим, что A + B = AB, то есть в результате гомогенной реакции катализатор остался без изменения.
При гетерогенном катализе скорость реакции зависит от площади поверхности катализатора (обычно в промышленности применяют твердые катализаторы: Pt, Fe, Ni, CuO, V2 O5 и др.), поэтому применяются катализаторы с развитой поверхностью или катализаторы, нанесенные на подложки с большой площадью поверхности (пористые угли, силикаты и др.).
Механизм гетерогенного катализа очень сложен и зависит от природы реакции. Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции. За счет энергии адсорбционного взаимодействия с поверхностными атомами катализатора ослабляются, а иногда и разрываются, химические связи реагирующих частиц. Таково действие положительных катализаторов. Отрицательные катализаторы (ингибиторы) замедляют химические процессы, что связано с увеличением энергии переходного состояния системы (точка А2 на рис.1).
Очень велика область применения ингибиторов на морском транспорте (для защиты от коррозии различных систем; присадки к топливам и маслам; ингибиторы окисления нефтепродуктов и др.).
ХИМИЧЕСКОЕ И АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- Химическое равновесие.
- Адсорбционное равновесие.
- Химическое равновесие.
Большинство химических реакций не протекает до конца. Реакции, которые могут одновременно протекать в двух взаимно противоположных направлениях, называются обратимыми. Если скорости таких реакций станут равными, 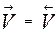 , то наступает состояние химического равновесия.
, то наступает состояние химического равновесия.
Состояние равновесия характеризует тот предел, до которого в данных условиях реакция, раз начавшаяся, протекает самопроизвольно(∆G < 0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарно-изотермического потенциала происходить не будет (см. рис.1)
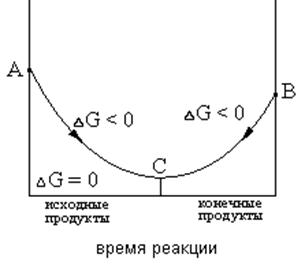
Рис.1 Изменение ∆G по мере протекания реакции

Для гомогенной обратимой реакции аА + bВ 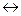 cC + dD состояние равновесия характеризуется константой равновесия
cC + dD состояние равновесия характеризуется константой равновесия 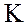 :
:
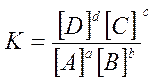
в случае газовых систем:
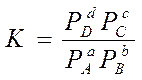 ,
,
Например, для реакции:
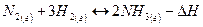
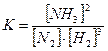 или
или 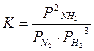
Особенностью гетерогенного химического равновесия является отсутствие в константах равновесия членов, относящихся к твердым веществам.
При данной температуре парциальные давления реагентов, находящихся в конденсированном (твердом и жидком) состоянии, постоянны и не зависят от количества реагентов. Поэтому эти парциальные давления обычно включают в константу равновесия. Так, для реакции
СаСО3(т) = СаО(т) + СО2(г); 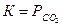 или К= [СО2]
или К= [СО2]
Константа равновесия связана с изменением изобарно-изотермического потенциала химической реакции ∆G° соотношением:
∆G° = - RTlnK
Так как ∆G° = ∆Нº - T∆S°; RlnK = ∆S° - ∆Нº/ T
отсюда К = е-∆Hº/RTe∆Sº/R
В условиях равновесия обратимой реакции ∆G° = ∆Н° - Т·∆S° = 0 можно рассчитать температуру, при которой наступает равновесие
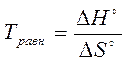
Из этих уравнений следует, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагирующих веществ определяет ее зависимость от энтальпийного (∆Нº) и энтропийного (∆S°) факторов.
От концентрации реагентов и от давления (если оно не очень высокое) константа равновесия не зависит. При изменении условий (температуры, давления, концентрации) состояние равновесия нарушается.
Смещение равновесия в зависимости от изменения условий в общем виде определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих равновесие, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведенного действия. Следовательно, повышение температуры смещает равновесие в сторону эндотермического процесса, а понижение – в сторону экзотермического процесса. Учитывая, что ∆Н = -Q
RlnК = ∆S° + Q/T (для экзотермической реакции).
RlnK = ∆S° - Q /T (для эндотермической реакции).
Вообще, в областях высоких температур характерны эндотермические реакции, а в областях низких температур - экзотермические. Повышение давления смещает равновесие в сторону образования меньшего количества газообразных молекул, повышение концентрации исходных веществ - в сторону образования продуктов реакции. При противоположном воздействии равновесие будет смещаться, соответственно, в сторону образования исходных веществ. Например, для экзотермической реакции 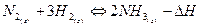 .
.
для смещения равновесия в сторону образования аммиака необходимо увеличить концентрации исходных веществ (причем наиболее выгодно увеличить концентрацию водорода), уменьшить концентрацию аммиака, понизить температуру или увеличить давление.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 576; Нарушение авторских прав?; Мы поможем в написании вашей работы!