
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водные растворы электролитов. Теории кислот и оснований. Сильные и слабые электролиты. Активность. Свойства растворов электролитов
|
|
|
|
Растворы, проводящие электрический ток, называются электролитами. Реакции с участием ионов протекают чаще всего в газовых и жидких растворах без изменения степени окисления элементов. Электролиты условно подразделяются на сильные и слабые электролиты.
В 1887г. С.Аррениус предложил теорию электролитической диссоциации.
Распад молекул электролитов на ионы под действием полярных молекул растворителя, называется электролитической диссоциацией.
И.А.Каблуков связал теорию электролитической диссоциации Аррениуса с химической теорией растворов Д.И.Менделеева и создал новую теорию электролитической диссоциации, согласно которой сначала протекает процесс сольватации (гидратации), а затем – процесс диссоциации на ионы. Эти ионы связаны с молекулами воды, т.е. гидратированы.
Для простоты написания в уравнениях диссоциации пишут формулы ионов, а не их гидратов или сольватов.
Способность к электролитической диссоциации (для ионных соединений) или ионизации (для соединений с полярной ковалентной связью) в растворе зависит не только от природы электролита, но и от природы растворителя. В зависимости от природы растворителя одно и тоже вещество может вести себя и как сильный электролит (NaCl в воде), и как слабый электролит (NaCl в бензоле).
Чем выше диэлектрическая проницаемость растворителя, тем сильнее ослабляется электростатическое притяжение разноименно заряженных ионов. На ионизацию электролита оказывает влияние полярность молекул растворителя.
Электростатическое взаимодействие особо заметно проявляется в растворах сильных электролитов, т.е. электролитов практически полностью распадающихся в растворе на ионы. Применительно к сильным электролитам равновесия типа:
NaCl  Na+ + Cl-
Na+ + Cl-
или
HNO3  H+ + NO3-
H+ + NO3-
следует понимать не как равновесие между ионами и недиссоциированными молекулами, а как равновесие между обособленными гидратированными ионами и исходными молекулами:
NaCl крист. + x H2O < = > Na+(H2O)n + Cl-(H2O)m
или
HNO3 + H2O < = > OH3+ + NO3-,
где x=n+m общее количество молей воды, участвующих в гидратировании ионов.
Наиболее известны теория, основанная на механизме электролитической диссоциации, протонная и электронная теории кислот и оснований. Согласно теории электролитической диссоциации, применимой к водным растворам, кислотой является электролит, который диссоциирует с образованием ионов Н+. Электролит, диссоциирующий с образованием ионов ОН-, называют основанием. Амфотерные электролиты могут диссоциировать как кислоты, и как основания:
H+ + RO- < = > ROH < = > R+ + OH--
Амфотерность электролитов объясняется малым различием прочности связей R -- Н и О -- Н. Примером амфотерного электролита может быть гидроксид цинка:
2Н+ + [Zn(ОН)4]2- < = > Zn(ОН)2 + 2Н2О < = > [Zn(Н2О)2]2+ + 2OH-
Теория электролитической диссоциации неприменима к взаимодействиям, не сопровождающимся диссоциацией на ионы.
В 1923 г. Д. Брендстедом была предложена протонная теория кислот и оснований, применяемая как к водным, так и неводным средам. Согласно протонной теории, кислоту считают донором протонов, а основание акцептором протонов.
В зависимости от партнера то или иное вещество может быть или кислотой, или основанием. Кислотно-основные свойства, согласно протонной теории, количественно характеризуются протонным сродством или энергией, которая выделяется при присоединении протона к молекуле или иону. Роль основания играет тот партнер, у которого протонное сродство выше. Например, вода по отношению к аммиаку является кислотой, а по отношению к фториду водорода — основанием:
Н2О + NН3 < = > ОН- + NН4+
HF + H2O < = > F- + OH3+
кислота основание основание кислота
В рассмотренных примерах вода имеет более высокое значение протонного сродства, чем фторид водорода, но меньшее значение этого сродства, чем аммиак.
В 1924 г. Дж. Льюис выдвинул и обосновал электронную теорию кислот и оснований, согласно которой кислота является акцептором, а основание - донором электронов. Взаимодействие кислоты и основания, по Льюису, приводит к образованию ковалентной связи по донорно-акцепторному механизм
H+ + [: F: ]- < = > H –: F:
кислота основание
H+ +  < = >
< = > 
кислота основание

кислота основание
Количественно процесс диссоциации определяется степенью ионизации (диссоциации) α электролита:
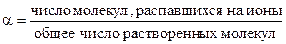
Степень диссоциации α выражается в процентах и долях единицы. Значение α увеличивается при разведении раствора и с повышением температуры в соответствии с правилом Ле-Шателье.
По величине α электролиты делятся на сильные, средние и слабые электролиты:
Сильные электролиты α>30%: HCl, H2SO4, HNO3, HClO4, HBr, HJ, KOH, Ba(OH)2, соли, и т.д.
Средние электролиты 3<α<30%: HF, H3PO4.
Слабые электролиты α<3%: HCN, H2S, H2CO3, H2SiO3, орган. кислоты, NH4OH, H2O.
Для характеристики растворов электролитов используется понятие активности иона. Активность - это эффективная концентрация, т.е. это доля общего числа ионов, которая проявляет себя в действии (влияет на электропроводность раствора, осмотическое давление, понижение давления пара и температуры замерзания раствора, повышение его температуры кипения и др.). Соотношение между активностью (эффективной концентрацией) и концентрацией (общей) с дается выражением:
α = γּc(9),
где 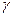 - коэффициент активности. Он является величиной, суммарно отражающей имеющие место в данной системе взаимодействия заряженных частиц.
- коэффициент активности. Он является величиной, суммарно отражающей имеющие место в данной системе взаимодействия заряженных частиц.
В концентрированных растворах коэффициент 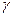 обычно меньше единицы. Для предельно разбавленных растворов взаимодействие ионов из-за их удаленности друг от друга практически отсутствует и коэффициент активности близок к единице, т.е.
обычно меньше единицы. Для предельно разбавленных растворов взаимодействие ионов из-за их удаленности друг от друга практически отсутствует и коэффициент активности близок к единице, т.е.
а≈ с
Для ионизации слабых электролитов в водных растворах применим закон действующих масс. Например:
СН3СООН....H2O < = > ОН3+ + СН3СОО-
или
СН3СООН < = > Н+ + СН3СОО-
Константа равновесия (т.е. константа диссоциации кислоты) имеет
вид: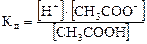
 — для слабого электролита величина постоянная при данной температуре и не зависит от концентрации раствора.
— для слабого электролита величина постоянная при данной температуре и не зависит от концентрации раствора.
Например, константа диссоциации гидроксида аммония:
NH4OH < = > NH4+ + OH-
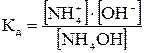


Для сильных электролитов закон действующих масс будет применим, если вместо концентрации вещества в выражение константы равновесия ввести активность. Для сильного электролита Кn Am(например, хлорида натрия):
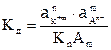
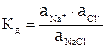
Многоосновные слабые кислоты и основания диссоциируют ступенчато, причем, константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем по предыдущей.
Например,
H2CO3  H + + HCO3 --
H + + HCO3 -- 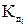 = 4,45 ּ10-7
= 4,45 ּ10-7
HCO3--  H+ + CO32-
H+ + CO32- 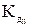 = 4,8 ּ10-11
= 4,8 ּ10-11
Zn (OH)2  ZnOH + + OH-
ZnOH + + OH- 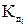 = 4,4 ּ10-5
= 4,4 ּ10-5
ZnOH+  Zn2+ + OH-
Zn2+ + OH- 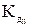 = 1,5 ּ10-9
= 1,5 ּ10-9
Для слабых электролитов, распадающихся на иона справедлив закон Оствальда:
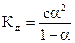 (10),
(10),
где c – концентрация слабого электролита.
При α<<1 уравнение (10) упрощается и 
Уравнение называется законом разбавления Оствальда.
Растворы электролитов являются ионными проводниками (проводниками второго рода). В них наблюдаются отклонения от законов Рауля и Вант-Гоффа. Эти законы применяются для растворов электролитов с учетом поправочного коэффициента i, называемого изотоническим коэффициентом:
i= 1 + α(n-1) (11),
где n – общее число ионов в растворе;
α-степень диссоциации.
Изотонический коэффициент характеризует отклонение от законов идеальных растворов вследствие увеличения числа частиц за счет ионизации (диссоциации) электролита:

DТ зам.=iKcm
DТкип= i Ecm
P осм = icRT
Изотонический коэффициент равняется отношению экспериментального значения P осм ( ,
,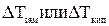 ) к рассчитываемому:
) к рассчитываемому:
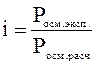
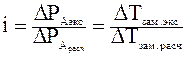
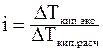
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 1134; Нарушение авторских прав?; Мы поможем в написании вашей работы!