
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный показатель среды, его роль в технологических операциях на флоте. Гидролиз солей
|
|
|
|
В соответствии с равновесием Н2О  Н+ + ОН- в воде присутствуют катионы водорода и анионы гидроксида в строго эквивалентных количествах. Константа ионизации воды:
Н+ + ОН- в воде присутствуют катионы водорода и анионы гидроксида в строго эквивалентных количествах. Константа ионизации воды:

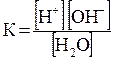
может быть определена по электропроводности. Тогда К [Н2О] =
=[Н+] [ОН-]. Величина [Н+]·[ОН-] =  = 10-14 (моль/л)2 называется ионным произведением воды. Поскольку в воде концентрации гидратированных ионов водорода и гидроксила равны, то
= 10-14 (моль/л)2 называется ионным произведением воды. Поскольку в воде концентрации гидратированных ионов водорода и гидроксила равны, то
[Н+] = [ОН-] = 10-7 моль/л (при 18°С).
Концентрация ионов водорода или гидроксила в растворе может служить мерой кислотности или щелочности среды.
В кислых растворах - [Н+] > 10-7, а в щелочных - [Н+] < 10-7.
На практике для характеристики кислотности и щелочности среды используют величины отрицательного десятичного логарифма концентрации водородных и гидроксильных ионов, которые называют водородным и гидроксильным показателями:
pН = -lg[Н+]; рОН = -lg[ОН-].
Тогда для нейтральной среды:
pН = -lg10-7 = 7.
Для определения рН используют так называемые кислотно-щелочные индикаторы, которые представляют собой слабые органические кислоты и основания, имеющие различную окраску в диссоциированной и молекулярной формах. Так, фенолфталеин (НJnd) в водном растворе диссоциирует по схеме:
НJnd = Н+ +Jnd-.
бесцветный малиновый
При добавлении щелочи равновесие смещается вправо, так как ионы Н+ связываются гидроксильными ионами в малодиссоциированные молекулы воды. Поэтому, в щелочной среде раствор приобретает малиновую окраску. Для количественного определения рН среды используют приборы, называемые рН-метрами.
Определение рН имеет большое значение в практике эксплуатации морского флота, так как эта характеристика позволяет управлять процессами накипеобразования и коррозии при работе судовых энергетических установок, оказывает влияние на условия хранения и перевозки грузов.
Концентрация ионов водорода в существенной мере зависит от протекания процессов гидролиза. В общем случае под гидролизом понимают реакции обменного разложения между водой и соответствующим соединением. Сущность гидролиза – соединение катионов соли с OH- или анионов соли с H+ воды.
С количественной стороны гидролиз характеризуется величиной константы гидролиза и степенью гидролиза.
Константу гидролиза называют константой равновесия реакции гидролиза соли КА:
КА + Н2О  КОН + НА
КОН + НА
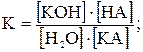 т.к.
т.к. 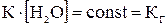 , то
, то 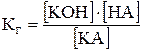
Константу гидролиза удобно связывать с константой ионизации кислоты (основания) и ионным произведением воды для конкретного случая гидролиза соли.
Степень гидролиза — это отношение числа гидролизованных молекул к общему их числу в растворе.
В соответствии с принципом Ле-Шателье для равновесных систем, усиление гидролиза достигается увеличением температуры и разбавлением раствора, а в концентрированных холодных растворах гидролиз сильно подавлен. Этому же способствует подкисление или подщелочение в зависимости от типа гидролитического взаимодействия.
Механизм гидролиза для разных типов соединения весьма различен. Так, гидролиз соединений (солей), распадающихся в растворе на ионы, можно рассматривать как результат поляризационного взаимодействия ионов с их гидратной оболочкой.
Характер и степень распада молекул гидратной оболочки зависят от природы катионов и анионов — чем сильнее поляризирующее действие ионов, тем в большей степени протекает гидролиз; чем меньше размеры и выше заряд ионов, тем выше их поляризирующее действие.
Суммарный эффект гидролиза определяется природой находящихся в растворе катионов и анионов.
1. Если соединение при ионизации в растворе образует катионы и анионы, которые слабо поляризуют гидратную оболочку, гидролиз практически не происходит и рН среды не изменяется (pH=7), то есть соли сильного основания и сильной кислоты гидролизу не подвергаются.
Например:NаСl  Nа+ + Сl-
Nа+ + Сl-
Na+ + НОН  реакция практически не идет
реакция практически не идет
Сl- + НОН реакция практически не идет.
реакция практически не идет.
2. Если соединение при ионизации образует катионы, которые поляризуют молекулы (Сu+2, Fe+2, Cr+3 и т.д.) гидратной оболочки, и анионы, слабополяризующие их (Сl-, Вr-, NО3-, J-, SO42-), то происходит гидролиз по катиону. При этом образуется кислая среда(pH<7).
Например: СuCl2  Cu+2 + 2Cl-
Cu+2 + 2Cl-
Cu+2 + НОН  СuОН+ + Н+
СuОН+ + Н+
Сl- + НОН  реакция практически не идет.
реакция практически не идет.
Или в молекулярной форме:
СuCl2 + НОН  [СuОН]Cl + НСl
[СuОН]Cl + НСl
Обобщая этот пример, можно сделать вывод, что гидролизу по катиону подвержены соли слабого основания и сильной кислоты.
Константа гидролиза для данного случая равна:

3. Если соединение при растворении ионизируется на слабо поляризующиеся катионы (катионы щелочных и щелочноземельных металлов) и анионы, поляризующие молекулы гидратной оболочки (СО32-, РО4-3, SО32-, S-2, CN-), то происходит гидролиз по аниону, и в результате гидролиза создается щелочная среда (pH>7):
Na2CO3  2Na+ + CO32-
2Na+ + CO32-
Na+ + НОН  реакция практически не идет
реакция практически не идет
СО32- + НОН  НСО3- + ОН-
НСО3- + ОН-
Или в молекулярной форме:
Na2CO3 + HOH  NaHCO3 + NaOH.
NaHCO3 + NaOH.
В этом случае обобщенно можно сказать, что гидролиз по аниону происходит у солей сильных оснований и слабых кислот.
Константа гидролиза равна:
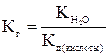
4. Если соединение при ионизации образует среднеполяризующие катионы и анионы, то происходит гидролиз и по катиону, и по аниону. При этом обычно наблюдается гидролиз с образованием слабых кислот и слабых оснований:
Аl2(CO3)3 + 6Н2О  2Аl(OH)3↓ + 3H2CO3.
2Аl(OH)3↓ + 3H2CO3.
Характер среды в этом случае определяется относительной силой образовавшихся кислоты и основания.
При Ккисл.>Коснов. Среда – слабокислая (pH 7).
7).
При Ккисл.< Коснов. Среда - слабощелочная (pH 7).
7).
При Ккисл.= Коснов. Среда – нейтральная (pH 7).
7).
Константа гидролиза равна:
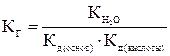
Итак, соли, образованные одноосновными кислотами и одноосновными основаниями, гидролизуются до кислот и оснований. Соли многоосновных кислот и многокислотных оснований подвергаются многоступенчатому гидролизу, и в числе продуктов гидролиза могут образовываться, соответ- ственно, кислые и основные соли.
При этом гидролиз по катиону протекает в тем большей степени, чем слабее отвечающее катиону основание. Смещение равновесия гидролиза зависит от рН среды. Кислая среда подавляет гидролиз по катиону.
Гидролиз по аниону протекает в тем большей степени, чем слабее соответствующая ему кислота. Реакция раствора за счет гидролиза по аниону становится щелочной. Щелочная среда подавляет гидролиз по аниону.
Лекция 6. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- Понятие об электродном потенциале.
- Гальванические элементы.
- Стандартный водородный электрод и водородная шкала потенциалов.
- Понятие о стандартном электродном потенциале. Уравнение Нернста.
- Понятие о стандартном окислительно-восстановительном потенциале. Направление окислительно-восстановительных процессов
В окислительно-восстановительных реакциях переход электронов от восстановителей к окислителям происходит непосредственно при контакте частиц. При этом энергия химической реакции превращается в теплоту. Но эти реакции проводить можно и в таких условиях, когда процессы окисления и восстановления пространственно разделены, т.е. восстановитель отдает окислителю электроны через проводник электричества, в результате чего возникает электрический ток.
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы: 1) процессы превращения химической энергии в электрическую (в гальванических элементах); 2) процессы превращения электрической энергии в химическую (электролиз).
О направлении окислительно-восстановительных реакций можно судить по изменению энергии Гиббса системы (DG). В соответствии с законами химической термодинамики окислительно-восстановительная реакция возможна при DG<0. Для количественной характеристики окислительно-восстановительной активности вещества используют электродные и окислительно-восстановительные потенциалы (Е).
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 803; Нарушение авторских прав?; Мы поможем в написании вашей работы!