
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости. Механизм накипеобразования
|
|
|
|
Ионные реакции в растворах. Условия одностороннего протекания реакций обмена.
Реакции в растворах электролитов между ионами называются ионообменными. Смещение химического равновесия (иногда практически необратимо) ионообменных реакций в растворах электролитов происходит при уменьшении концентрации каких-либо ионов за счет образования малорастворимых или летучих соединений, мало ионизирующихся молекул или комплексных ионов (правило Бертолле):
Например:
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
Ba+2 + SO42- = BaSO4
Na2S + 2HCl = 2NaCl + H2S↑
S2- + 2H+ = H2S
HCl + KOH = KCl +H2O
H++ OH- = H2 O
Cu(OH)2+ 4NH3 = [ Cu(NH3)4 ] (OH)2
Cu(OH)2 + 4NH3 = [ Cu(NH3)4 ]2++ 2OH-
Zn(OH)2 + 2KOH = K2[ Zn(OH)4]
Zn(OH)2+ 2OH- = [ Zn(OH)4]2-
Большое значение в практической деятельности судомеханика имеет представление о гетерогенном равновесии в растворах электролитов, которое лежит в основе механизма накипеобразования при эксплуатации энергетических установок.
Подавляющее большинство электролитов обладает ограниченной растворимостью в воде. На практике часто встречаются гетерогенные системы, в которых осадок малорастворимого электролита находится в равновесии с насыщенным раствором этого электролита:
растворение


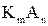 mK
mK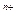 + nA
+ nA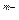


осадок кристаллизация раствор
CaCl2 + H2SO4 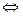 CaSO4↓ + 2HCl
CaSO4↓ + 2HCl
Ca2+ + SO42- 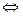 CaSO4↓
CaSO4↓
раствор осадок
Произведение активностей ионов в насыщенном растворе малорастворимого электролита при заданной температуре есть величина постоянная и называется произведением растворимости ПР:
K = ПРK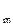 A
A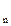 = а
= а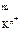 а
а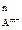
Произведение растворимости как и константа равновесия зависит от природы электролита и от температуры, но не зависит от активности ионов в растворе.
Поскольку раствор малорастворимого соединения получается очень разбавленным, и взаимодействие ионов из-за их удаленности друг от друга практически отсутствует, коэффициент активности близок к единице, то активности ионов в растворе можно приравнять к их концентрациям, и произведение растворимости может быть записано в следующей форме:
ПРK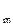 A
A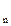 =[K
=[K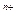 ]
]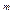 ·[A
·[A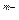 ]
]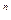
Произведение растворимости характеризует растворимость вещества: чем больше ПР, тем больше растворимость.
Часто вместо значений ПР применяют показатель растворимости рПР - отрицательный логарифм произведения растворимости, рПР= - lgПР.
Если произведение концентраций ионов электролита в растворе равно ПР, то раствор находится в равновесии с твердой фазой (осадком).
Когда [K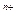 ]
]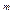 ·[A
·[A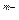 ]
]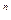 >ПР, равновесия нет при этих концентрациях, и из раствора будет выделятся твердая фаза (осадок).
>ПР, равновесия нет при этих концентрациях, и из раствора будет выделятся твердая фаза (осадок).
Если же [K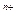 ]
]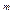 ·[A
·[A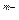 ]
]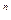 <ПР, то снова нет равновесия, но раствор в этом случае ненасыщен относительно твердой фазы, и она будет переходить в раствор.
<ПР, то снова нет равновесия, но раствор в этом случае ненасыщен относительно твердой фазы, и она будет переходить в раствор.
Под действием одноименного иона равновесие смещается по принципу
Ле-Шателье в сторону образования осадка. Например:
CaSO4<=>Ca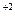 + SO4
+ SO4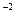
осадок раствор
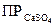 =
= 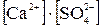
при введении дополнительного иона Ca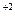 в раствор, равновесие будет смещаться влево.
в раствор, равновесие будет смещаться влево.
Этим объясняется повышенное накипеобразование при наличии, например, в котловой воде даже следов одноименных ионов, содержащихся в качестве примесей при различного рода нарушениях воднохимических режимов.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 507; Нарушение авторских прав?; Мы поможем в написании вашей работы!