
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы идеальных растворов. Растворы неэлектролитов и электролитов
|
|
|
|
Для количественного описания свойств растворов используют модель идеального раствора, (в котором нет химического взаимодействия между компонентами). Свойства раствора при данных условиях определяются только концентрацией растворенного вещества, а не их химическим составом. Из реальных растворов только разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
К числу таких свойств относятся:
а) понижение давления пара над раствором;
б) повышение температуры кипения раствора;
в) понижение температуры замерзания раствора;
г) осмотическое давление.
Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем.
Относительное понижение давления насыщенного пара растворителя (PAo) над раствором (PA) равно молярной доле (NB) растворенного вещества (закон Рауля):
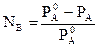 (3)
(3)
При этом DPA= PAo - PA тем значительнее, чем выше концентрация растворенного вещества.
Растворы замерзают при температурах более низких, чем чистые растворители.
Понижение температуры замерзания DTзам пропорционально моляльности раствора (сm) (закон Рауля):
DТзам= К . сm (4),
где К – криоскопическая константа (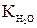 = 1,86)
= 1,86)
Разбавленные растворы кипят при более высоких температурах, чем чистые растворители.
Повышение температуры кипения DTкип пропорционально моляльности раствора (закон Рауля)
DТкип=Е . сm, (5)
где Е – эбулиоскопическая константа (ЕH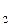 О=0,52)
О=0,52)
Криоскопическая и эбулиоскопическая константы зависят только от природы растворителя.
Уравнения (4) и (5) используются для расчета молярных масс (М) малолетучих неэлектролитов. Если известна масса растворенного вещества m и масса растворителя m1, то молярную массу растворенного вещества М определяют по уравнениям:
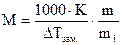 (6);
(6); 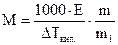 (7);
(7);
Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую перегородку.
Осмотическое давление (Росм.) – это давление, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перегородкой (закон Вант-Гоффа):
Росм= с . R . T (8),
где с – молярная концентрация раствора неэлектролита. Осмотическое давление равно силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку.
Осмотическое давление измеряют в осмометрах (рис. 1). Оно равно давлению столба раствора высотой h. При равновесии внешнее давление уравновешивает осмотическое давление.
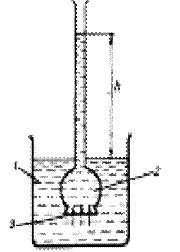
Рис 1. Схема осмометра:
1-вода; 2-раствор; 3-полупроницаемая мембрана.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 865; Нарушение авторских прав?; Мы поможем в написании вашей работы!