
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальні гази
|
|
|
|
Реальні гази – не підлягають повністю рівнянню стану ідеального газу.
Відхилення властивостей реальних газів від властивостей ідеального газу пояснюються:
ü наявністю сил притягання між молекулами (підвищення тиску та зниження температури сприяє зростанню сил притягання);
ü наявністю певного об’єму в кожній молекулі газу (в кінетичній теорії нехтують об’ємом молекул).
Рівняння стану реального газу Ван-дер-Ваальса (1873) описує стан реального газу при високих тисках і низьких температурах:
(Р + а ∙ ν2/V) ∙ (V – ν ∙ b) = ν ∙R ∙ T,
де а ∙ ν2/V – враховує вплив сил притягання між молекулами;
ν ∙ b – власний об’єм частинок і взаємне відштовхування на малих відстанях.
Сталі а і b підбирають емпірично для кожного конкретного газу. Наприклад, для СО2: а = 3,592л2∙атм∙моль; b = 42,67см3∙моль-1.
Рівняння Ван-дер-Ваальса враховує не всі причини відхилень властивостей реальних газів від властивостей ідеального газу, тому його застосування обмежене і поширюється лише на речовини із постійним складом молекул.
Для обчислення властивостей реальних газів використовують рівняння:
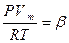 ,
,
де β ‑ фактор стисливості (стала величина), залежить від природи речовини, від параметрів стану газу.
Рівняння справедливе тільки у вузькому інтервалі зміни тиску, температури та питомого (молярного) об’єму досліджуваного газу.
Ізотерми Ендрюса для СО2:
 Д Д Д Д Д Д
    Р
В=С Р
В=С
 321К
С В 304К 321К
С В 304К
 
  А 295К
С В
А А 295К
С В
А
 V
V
| Відрізок АВ – газоподібний стан, підпорядковується закону Бойля – Маріотта: Р↑, V↓ Відрізок ВС – перехід газу в рідкий стан (рівновага рідина – пара). З підвищенням температури відрізок ВС зменшується, при t = 31,30С (304К) переходить в т. В=С (критичний стан). Відрізок СД – відповідає рідині: Р↑, V=const. При подальшому підвищенні температури ізотерми наближаються до ізотерми ідеального газу. Умови зрідження газів (спрямовані на збільшення сил притягання між частинками): Ä Високий тиск; Ä Низька температура (сприяє зниженню кінетичної енергії Ек та руху частинок). |
Теорія зрідження газів (Менделєєв, 1860)
S Для кожного газу існує критична температура (tкрит), вище якої газ ні за яких умов не може бути перетворений на рідину.
S Мінімальний тиск, необхідний для зрідження газу, при його критичній температурі, називається критичним тиском (Ркрит).
S Об’єм, який займає один моль газу, при критичних тиску та температурі, називається критичним об’ємом (Vкрит).
S Стан газу, який знаходиться під критичним тиском, при критичній температурі й займає критичний об’єм, називається критичним станом.
Наприклад, критичний стан для СО2 визначається такими параметрами: Ркрит = 72,9атм., tкрит = 31,30С, Vкрит = 0,096л
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!