
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Графічне зображення І закону Рауля (для ідеального розчину) Т=const
|
|
|
|
Thorn; Гіпотонічні (πосм. зовнішнього розчину < Р у середині клітини) – клітина знаходиться в розбавленому розчині, відбувається дифузія води в клітину із зовнішнього розчину, збільшується об’єм клітинного соку, клітина набухає.
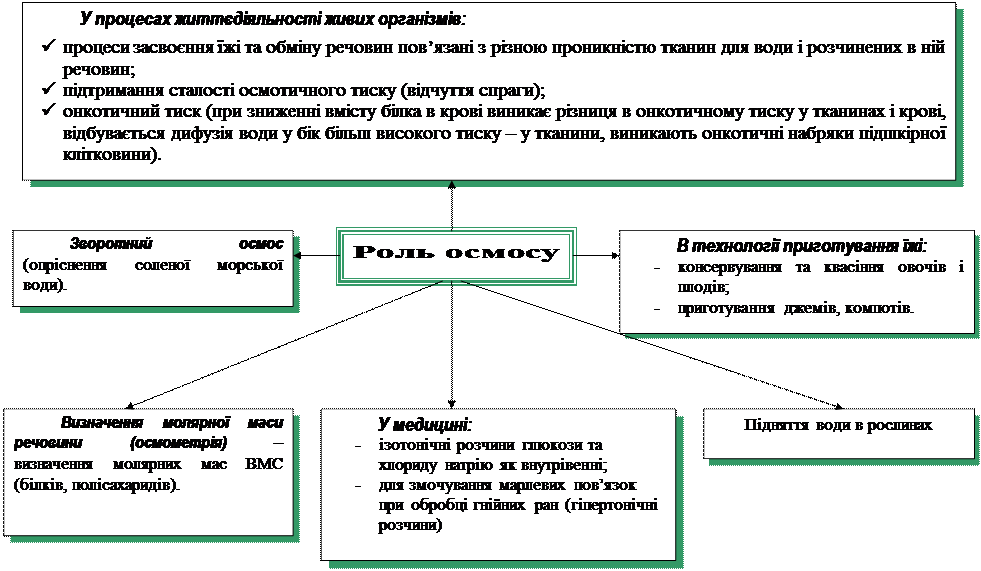
Осмос – довільний перехід розчинника через напівпроникну мембрану з розбавленого розчину (чистого розчинника) в концентрований розчин. Явище осмосу можна спостерігати за допомогою приладу ‑ осмометра.
Експеримент, який показує дію осмотичного тиску:
| Початок експерименту | Кінець експерименту | |||||
               2 2
 1 1
| 1 – вода 2 – концентрований розчин цукру 3 ‑ напівпроникна мембрана Система, що утворилася – нерівноважна. Внаслідок цього в ній починається самочинний процес вирівнювання концентрацій: молекули розчинника (води) переходять у посудину 2 з розчином цукру. |               
| Внаслідок осмосу об’єм рідини у посудині 2 збільшиться і розчин почне підійматись. Для припинення осмосу необхідно ззовні до розчину прикласти тиск, що спричинятиме зворотний процес – вихід молекул розчинника з розчину. Цей тиск ‑ осмотичний тиск, πосм (рівноважний гідростатичний тиск) | |||
Осмотичний тиск ( осм.) – тиск, який необхідно прикласти до концентрованого розчину, щоб завадити перенесенню розчинника через мембрану.
осм.) – тиск, який необхідно прикласти до концентрованого розчину, щоб завадити перенесенню розчинника через мембрану.
Якщо Рзовнішній > 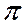 осм. – зворотний осмос (одержання питної води з морської, очищення стічних вод). Причиною того, що на солонцюватих ґрунтах не всі рослини можуть проростати є зворотний (обернений) осмос.
осм. – зворотний осмос (одержання питної води з морської, очищення стічних вод). Причиною того, що на солонцюватих ґрунтах не всі рослини можуть проростати є зворотний (обернений) осмос.
Закон осмотичного тиску для розведених розчинів неелектролітів (Вант-Гофф, 1887): осмотичний тиск розчину дорівнює тому тиску, який чинила б розчинена речовина, якби вона при тій же температурі перебувала у газоподібному стані і займала б об’єм, рівний об’єму розчину (осмотичний тиск розчину прямо пропорційний його концентрації та температурі).
πосм =  ,
Якщо V=1л, то v =См
πосм.= СмRT
πосм. = ,
Якщо V=1л, то v =См
πосм.= СмRT
πосм. = 
| πосм. ‑ осмотичний тиск розчину (Па); v ‑ кількість молей розчиненої речовини (моль); V – об’єм розчину (м3); R – універсальна газова стала 8,31 Дж/(моль∙ К); Т – абсолютна температура (К); См – молярна концентрація розчиненої речовини (моль/л); m – маса розчиненої речовини (г); μ ‑ молярна маса розчиненої речовини (г/моль). |
Висновки:
a Осмотичний тиск залежить від концентрації розчиненої речовини, а не від її хімічного складу.
a Осмотичний тиск пропорційний різниці концентрацій у розчинах, що розділені мембраною (Т=const).
a Осмотичний тиск пропорційний температурі (∆С=const).
За осмотичним тиском розчини класифікують на:
þ Гіпертонічні (πосм . зовнішнього розчину > Р у середині клітини): клітина знаходиться в концентрованому розчині, відбувається дифузія води з клітини в розчин, об’єм клітини зменшується (цитоплазма відокремлюється від оболонки), клітина зморщується.
Плазмоліз – явище зморщування клітини в гіпертонічному розчині внаслідок втрати води (при консервуванні овочів і плодів, приготуванні джемів, повидла, варення; в медицині як зовнішнє для змочування марлевих пов’язок, що вводять у гнійні рани).
Тургор – явище збільшення клітини в об’ємі, набухання в гіпотонічному розчині (при варінні компотів, гемоліз еритроцитів).
þ Ізотонічні (πосм . зовнішнього розчину = Р у середині клітини) – стан клітини не змінюється. У медицині вводять внутрівенно для компенсації втрат крові: π осм. 0,85%-ного NaCІ = 7,5  105Па; πосм.4,5-5%-ного C6Н12О6 = 7,5
105Па; πосм.4,5-5%-ного C6Н12О6 = 7,5  105Па;
105Па;
π осм. крові людини = 7,4  105 - 7,8
105 - 7,8  105 Па (t=37оС).
105 Па (t=37оС).
 |
Властивості розчину завжди відрізняються від властивостей кожного з його компонентів. Ця зміна властивостей зумовлена:
1. характером взаємодії між компонентами;
2. зменшенням концентрації молекул кожної з речовин під час розподілу в ній молекул іншої речовини.
Вплив цих чинників зростає із збільшенням концентрації розчиненої речовини.
Тиск насиченої пари – це тиск, при якому (при певній температурі) досягається динамічна рівновага, що характеризується рівністю швидкостей випаровування та конденсації рідини.
Внаслідок випаровування над рідиною утворюється пара, тиск якої можна виміряти за допомогою манометра. Одночасно з ендотермічним процесом випаровування відбувається зворотний екзотермічний процес конденсації. За певних умов між цими процесами встановлюється рівновага (ΔG = 0). Рівноважний стан системи рідина – пара за певної температури характеризується тиском насиченої пари.
Якщо в рідині розчинена нелетка речовина, то вона утруднює випаровування розчинника (між молекулами розчинника і розчиненої речовини відбувається взаємодія) при цьому зменшується концентрація молекул розчинника в одиниці об’єму, зменшується кількість молекул, що випаровуються за одиницю часу з рідкої фази у пароподібну. Згідно з принципом Ле Шательє, починається процес, спрямований на зменшення зовнішнього впливу, тобто відбувається процес конденсації, що призводить до зниження тиску пари. Рівновага між рідиною і парою встановиться при нижчій концентрації пари, тобто при нижчому тиску пари.
þ Р насиченої пари розчинника над розчином < Р насиченої пари розчинника над чистим розчинником.
þ Зниження тиску пари над розчином буде більшим, чим вища концентрація розчиненої речовини у розчині.
І закон Рауля (1887): відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини.
І закон Рауля встановлює залежність тиску пари від концентрації розчину: тиск насиченої пари розчинника над розчином (Р а) прямо пропорційний молярній долі розчинника (N a).
Р а = Р а о  N a, де Р а о – тиск пари над розчинником;
N a, де Р а о – тиск пари над розчинником;
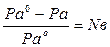 , де N в – молярна доля розчиненої речовини;
, де N в – молярна доля розчиненої речовини;
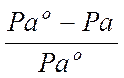 ‑ відносне зниження тиску насиченої пари розчинника над розчином.
‑ відносне зниження тиску насиченої пари розчинника над розчином.
Закон Рауля точно виконується тільки для ідеальних розчинів.

| В- чистий компонент В (менш леткий) А – чистий компонент А (більш леткий) Сумарний тиск парів 2-х компонентного розчину (Р) та парціальний тиск пари більш леткого компоненту (Р а о) збільшується зі збільшенням молярної долі більш леткого компоненту (N a) Одночасно парціальний тиск менш леткого компоненту розчину (Рв) зменшується. | 
|
Відхилення від закону Рауля:
Позитивні
Р пари експ. > Р пари обчисл.
Бензол + етанол; вода + етанол
Сили притягання А..В < Сили притягання А..А та В..В
Р рідина Т=const
В А
| Негативні
Р пари експерим. < Р пари обчисл.
Метанол + вода; азотна кислота + вода
         Сили притягання А..В < Сили притягання А..А та В..В
Р рідина Т=const
пара
В А Сили притягання А..В < Сили притягання А..А та В..В
Р рідина Т=const
пара
В А
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 567; Нарушение авторских прав?; Мы поможем в написании вашей работы!

 3
3



 пара
пара