
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція №12. Властивості розбавлених розчинів електролітів
|
|
|
|
Основні питання:
1. Електроліти. Відхилення властивостей розчинів електролітів від законів Рауля, Вант-Гоффа.
2. Сильні електроліти. Теорія сильних електролітів.
3. Слабкі електроліти. Константа дисоціації. Закон розведення Оствальда.
4. Водневий показник. Методи визначення рН.
5. Вплив рН середовища на перебіг ферментативних і технологічних процесів. Буферні суміші.
Електроліти – речовини, розплави або розчини яких, проводять електричний струм.
Ступінь дисоціації (α) – відношення числа частинок електроліту, що розпалися на іони, до загального числа його частинок у розчині.
α = 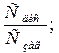 α = 1 – дисоціація повна; α = 0 – дисоціація відсутня; 0< α < 1 – часткова дисоціація.
α = 1 – дисоціація повна; α = 0 – дисоціація відсутня; 0< α < 1 – часткова дисоціація.
α залежить від:
ü природи електроліту та розчинника;
ü концентрації електроліту (С↓, α ↑);
ü температури (Т↑, α ↑).
Експериментальне визначення ступеня дисоціації (α) проводиться:
Ø за значенням ізотонічного коефіцієнта;
Ø вимірюванням електропровідності розчинів різних концентрацій.
Колігативні властивості розчинів електролітів не підлягають законам Вант-Гоффа і Рауля.
Основна ознака дисоціації – експериментальні дані більші теоретично обчислених за формулами для розчинів неелектролітів.
Для оцінки міри відхилення від ідеальних розчинів використовують ізотонічний коефіцієнт Вант-Гоффа – відношення відповідних експериментальних значень величин зниження тиску пари, зміни температури кипіння та замерзання, осмотичного тиску до теоретично обчислених.
і = 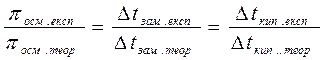
  Залежно від значення ступеня дисоціації електроліти поділяють на: Залежно від значення ступеня дисоціації електроліти поділяють на:
| |
Сильні електроліти (α>0,3) – повністю дисоційовані на іони у розчинах будь – яких концентрацій.
Належать: розчинні солі, гідроксиди лужних і лужноземельних металів, мінеральні кислоти (HCl, HNO3, H2SO4, HСlO4).
ί = 1+(n ‑ 1) · αуявн.
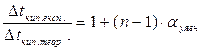
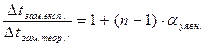
 Фактично виміряний ступінь дисоціації сильних електролітів (<1) називається уявним ступенем дисоціації.
З розведенням розчину αуявн. зростає і наближається до αіст..
n– кількість іонів, що утворюються в результаті дисоціації молекули електроліту.
Δtкип.експ., Δtзам.експ., πосм.експ. – експериментальні значення підвищення температури кипіння, зниження температури замерзання, осмотичного тиску.
Δtкип.теор.., Δtзам.теор.., πосм.теор. – теоретично обчислені значення підвищення температури кипіння, зниження температури замерзання, осмотичного тиску розчинів за формулами для розчинів неелектролітів.
Теорія сильних електролітів (Дебай, Гюккель, 1923): особливості розчинів сильних електролітів зумовлені наявністю в розчинах міжіонних взаємодій (посилюються зі збільшенням концентрації електроліту).
▪ Кожен іон утворює навколо себе іонну атмосферу (оболонку з іонів протилежного заряду);
▪ Іонна атмосфера під дією електричного поля рухається в зворотному напрямі, центральний іон відтягується назад (іонноелектрофоретичний ефект) – зниження рухливості іона.
▪ Під час руху іонна атмосфера весь час порушується, позаду іона залишаються залишки іонної хмари, які гальмують його рух (релаксаційний ефект).
Результат – зменшення електропровідності розчину (α < 1).
Поняття активності іонів (Льюїс, 1907) – для характеристики властивостей і стану іонів у розчинах сильних електролітів.
Активність (а) – це реальна концентрація з урахуванням взаємодії іонів;
а = f · с, де
f – коефіцієнт активності, характеризує ступінь відхилення властивостей, визначається експериментально (f < 1)
f залежить від:
ü природи електроліту;
ü температури;
ü іонної сили розчину (І) – у різних електролітів з однаковими величинами іонної сили, коефіцієнти активності однакові.
a Розчини електролітів, які використовуються як кровозамінники, повинні мати однакові значення іонної сили з електролітами, що знаходяться у крові.
a У біохімічних дослідженнях, змінюючи іонну силу електролітів, можна збільшити або зменшити розчинність білків і амінокислот, що використовуються для їх розділення.
Фактично виміряний ступінь дисоціації сильних електролітів (<1) називається уявним ступенем дисоціації.
З розведенням розчину αуявн. зростає і наближається до αіст..
n– кількість іонів, що утворюються в результаті дисоціації молекули електроліту.
Δtкип.експ., Δtзам.експ., πосм.експ. – експериментальні значення підвищення температури кипіння, зниження температури замерзання, осмотичного тиску.
Δtкип.теор.., Δtзам.теор.., πосм.теор. – теоретично обчислені значення підвищення температури кипіння, зниження температури замерзання, осмотичного тиску розчинів за формулами для розчинів неелектролітів.
Теорія сильних електролітів (Дебай, Гюккель, 1923): особливості розчинів сильних електролітів зумовлені наявністю в розчинах міжіонних взаємодій (посилюються зі збільшенням концентрації електроліту).
▪ Кожен іон утворює навколо себе іонну атмосферу (оболонку з іонів протилежного заряду);
▪ Іонна атмосфера під дією електричного поля рухається в зворотному напрямі, центральний іон відтягується назад (іонноелектрофоретичний ефект) – зниження рухливості іона.
▪ Під час руху іонна атмосфера весь час порушується, позаду іона залишаються залишки іонної хмари, які гальмують його рух (релаксаційний ефект).
Результат – зменшення електропровідності розчину (α < 1).
Поняття активності іонів (Льюїс, 1907) – для характеристики властивостей і стану іонів у розчинах сильних електролітів.
Активність (а) – це реальна концентрація з урахуванням взаємодії іонів;
а = f · с, де
f – коефіцієнт активності, характеризує ступінь відхилення властивостей, визначається експериментально (f < 1)
f залежить від:
ü природи електроліту;
ü температури;
ü іонної сили розчину (І) – у різних електролітів з однаковими величинами іонної сили, коефіцієнти активності однакові.
a Розчини електролітів, які використовуються як кровозамінники, повинні мати однакові значення іонної сили з електролітами, що знаходяться у крові.
a У біохімічних дослідженнях, змінюючи іонну силу електролітів, можна збільшити або зменшити розчинність білків і амінокислот, що використовуються для їх розділення.
| Слабкі електроліти(α < 0,03) –частково дисоціюють на іони у розчинах будь-яких концентрацій.
Належать: основи, солі (погано розчинні), кислоти (H2S, H3BO3, H2CO3, HCN, H2SO3, H2SiO3, HNO2).
αуявн. = αіст. (незначна між іонна взаємодія).
Дисоціація слабкого електроліту:
КА ↔ К+ + А-
Кдис. = 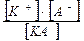 Кдис. – константа дисоціації, характеризує здатність електроліту до дисоціації (чим більше її значення, тим сильніший електроліт).
При ступінчастій дисоціації:
К2А ↔ К+ + КА-; К1=
Кдис. – константа дисоціації, характеризує здатність електроліту до дисоціації (чим більше її значення, тим сильніший електроліт).
При ступінчастій дисоціації:
К2А ↔ К+ + КА-; К1= 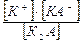 КА- ↔ К+ + А2-; К2 =
КА- ↔ К+ + А2-; К2 =  Сумарна реакція:
К2А ↔ 2К+ + А2-; К =
Сумарна реакція:
К2А ↔ 2К+ + А2-; К = 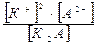 К – загальна константа дисоціації;
К1 – ступінчаста константа дисоціації (І стадія);
К2 – ступінчаста константа дисоціації (ІІ стадія),
причому К1> К2 , К = К1·К2
рК а = ‑ lgK a, де К а – константа іонізації кислоти;
рК b = ‑ lgK b, де К b – константа іонізації основи.
Кдис. не залежить:
ü від концентрації електроліту в розчині.
За величиною Кдис. слабкі електроліти поділяють :
▪ відносно слабкі (Кдис. = 10-2 – 10-4);
▪ слабкі (Кдис. = 10-5 – 10-9);
▪ дуже слабкі (Кдис. < 10-9).
Зв’язок між ступенем дисоціації електроліту та його константою дисоціації – закон розведення (розбавляння) Оствальда (1888).
Кдис. =
К – загальна константа дисоціації;
К1 – ступінчаста константа дисоціації (І стадія);
К2 – ступінчаста константа дисоціації (ІІ стадія),
причому К1> К2 , К = К1·К2
рК а = ‑ lgK a, де К а – константа іонізації кислоти;
рК b = ‑ lgK b, де К b – константа іонізації основи.
Кдис. не залежить:
ü від концентрації електроліту в розчині.
За величиною Кдис. слабкі електроліти поділяють :
▪ відносно слабкі (Кдис. = 10-2 – 10-4);
▪ слабкі (Кдис. = 10-5 – 10-9);
▪ дуже слабкі (Кдис. < 10-9).
Зв’язок між ступенем дисоціації електроліту та його константою дисоціації – закон розведення (розбавляння) Оствальда (1888).
Кдис. =  ,
для дуже слабких електролітів: α <1, (1-α) → 1:
α = ,
для дуже слабких електролітів: α <1, (1-α) → 1:
α =  Висновки:
▪ ступінь дисоціації зростає з розведенням розчину водою;
▪ чим більша константа дисоціації слабкого електроліту, тим більший ступінь дисоціації.
Увага!
Основні положення теорії електролітичної дисоціації стосуються електролітів, які зазнають неповної дисоціації. Оборотний характер процесу дисоціації, його ступінчастість втрачають зміст при наявності в розчині сильного електроліту (α =1)
Основні положення ТЕД (Арреніус, 1887)
ü Розчинення електроліту супроводжується розпадом його молекул на іони (дисоціація).
ü Електролітична дисоціація є оборотним процесом.
ü Електропровідність розчинів електролітів пропорційна загальній концентрації іонів у розчині.
ü Дисоціація (іонізація) відбувається під впливом полярних молекул розчинника з утворенням сольватів (гідратів).
ü Одночасно з дисоціацією відбувається – асоціація.
ü Сольватні (гідратні) оболонки іонів заважають іонам утворювати молекули вихідних речовин.
Висновки:
▪ ступінь дисоціації зростає з розведенням розчину водою;
▪ чим більша константа дисоціації слабкого електроліту, тим більший ступінь дисоціації.
Увага!
Основні положення теорії електролітичної дисоціації стосуються електролітів, які зазнають неповної дисоціації. Оборотний характер процесу дисоціації, його ступінчастість втрачають зміст при наявності в розчині сильного електроліту (α =1)
Основні положення ТЕД (Арреніус, 1887)
ü Розчинення електроліту супроводжується розпадом його молекул на іони (дисоціація).
ü Електролітична дисоціація є оборотним процесом.
ü Електропровідність розчинів електролітів пропорційна загальній концентрації іонів у розчині.
ü Дисоціація (іонізація) відбувається під впливом полярних молекул розчинника з утворенням сольватів (гідратів).
ü Одночасно з дисоціацією відбувається – асоціація.
ü Сольватні (гідратні) оболонки іонів заважають іонам утворювати молекули вихідних речовин.
|

Розрізняють:
Ø Загальну кислотність (лужність) ‑ число моль еквівалентів кислоти (лугу), що містяться в 1л розчину (відповідає загальній концентрації кислоти або лугу).
Ø Активну кислотність (лужність) – концентрація вільних гідратованих іонів Н+ (або ОН -).
| Сильні електроліти рН= -lg[Н+] – для сильної кислоти; рН=14 ‑ рОН – для сильної основи; рОН= ‑ lg[ОН-] – гідроксидний показник; Загальна кислотність (лужність) дорівнює активній кислотності (лужності). Загальна кислотність визначається титруванням. Активна кислотність визначається вимірюванням рН. | Слабкі електроліти рН= ‑ ½ рК a – ½ lgС а – для слабкої кислоти, де К а і С а – константа іонізації та концентрація слабкої кислоти. рН= ‑ ½ рКb– ½ lgСb – для слабкої основи, де Кв і Св – константа іонізації та концентрація слабкої основи. У розчині слабкої кислоти: [Н+]<С а У розчині слабкої основи: [ОН-]<Сb Загальна (лужність) відрізняється від активної кислотності (лужності). |
До складу шлункового соку входять кислоти різної сили, але його кислотність визначається тільки концентрацією іонів водню. Тому безпосереднє вимірювання рН і титрування шлункового соку дадуть різні результати.
Кислотність молока виражають в одиницях титрованої кислотності (у градусах Тернера) і величиною рН при 20оС.
Титрована кислотність свіжовидоєного молока становить 16-18оТ, зумовлена кислими солями – дигідрофосфатами і і дигідроцитратами, казеїном і білками сироватки, вуглекислим газом, кислотами (молочною, лимонною, аскорбіновою, вільними жирними), є критерієм оцінки якості молока при його заготівлі.
При зберіганні сирого молока титрована кислотність зростає відповідно із розвитком у ньому молочнокислих бактерій, які перетворюють лактозу в молочну кислоту. Підвищення кислотності – небажаний процес, знижується стійкість білків молока до нагрівання. Молоко з кислотністю 21оТ приймають як несортове.
Активна кислотність молока – рН ‑ зумовлена дисоціацією кислот і кислих солей, становить 6,5 (відносно стійка завдяки буферній системі). При розвитку в молоці молочнокислих бактерій суттєво зростає титрована кислотність, рН- практично не змінюється.

|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 745; Нарушение авторских прав?; Мы поможем в написании вашей работы!