
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм химических реакций при горении
|
|
|
|
Вопрос № 1. Основные закономерности протекания процессов горения
(30 мин.)
Как следует из самого определения пожара – основной процесс, протекающий на пожаре, это горение.
Поскольку процесс горения является сложным, однозначного определения горения нет, различные авторы предлагают собственные определения.
Различия в трактовке понятия горения вызваны направлением научных интересов авторов. На наш взгляд, практическим интересам сотрудников ГПС наиболее полно отвечает следующее определение горения:
Горение – это самоподдерживающийся сложный физико-химический процесс, основой которого являются быстропротекающие химические реакции окисления, сопровождающиеся выделением большого количества тепла и света.
Доминирующим процессом при горении является химическая реакция окисления, именно она влечет появление различных физических процессов: переноса тепла, переноса реагирующих веществ, излучения и др. Эти физические процессы развиваются по своим законам. Химические процессы окисления обладают большими потенциальными возможностями по скорости их протекания, но реальная скорость горения на реальных пожарах ниже, т.к. лимитируется скоростями физических процессов.
Химические реакции при горении являются многостадийными, а главное, цепными. Не разобравшись в механизме, происходящих процессов, невозможно понять причины распространения пламени, различие в его скоростях, величину температуры горения и др.
В теме «Химическая кинетика» мы отмечали, что химические реакции происходят при непосредственном контакте реагирующих компонентов (молекул, атомов, радикалов), но только в тех случаях, когда их энергия превышает определенный энергетический предел, называемый энергией активации Еа. Изобразим графически изменение энергии реагирующих компонентов (горючего и окислителя) и продуктов реакции при горении (рис.1.1.)
По оси абсцисс изображен путь реакции горения, по оси ординат – энергия. 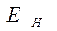 – средняя начальная энергия реагирующих компонентов,
– средняя начальная энергия реагирующих компонентов, 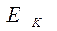 - средняя энергия продуктов горения.
- средняя энергия продуктов горения.
 |
Рис 1.1. Изменение энергии реагирующих веществ и продуктов реакции при горении
В реакцию горения будут вступать только активные частицы горючего и окислителя, которые будут обладать энергией, необходимой для вступление во взаимодействие, т.е. способные преодолеть энергетический барьер  . Избыточная энергия активных частиц по сравнению со средней энергией
. Избыточная энергия активных частиц по сравнению со средней энергией  , называется энергией активации
, называется энергией активации 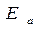 . Поскольку реакции, протекающие при горении являются экзотермическими
. Поскольку реакции, протекающие при горении являются экзотермическими 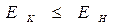 . Разность энергий образовавшихся продуктов горения и исходных веществ (горючего и окислителя) определяет тепловой эффект реакции:
. Разность энергий образовавшихся продуктов горения и исходных веществ (горючего и окислителя) определяет тепловой эффект реакции:
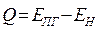
 |
Доля активных молекул возрастает при увеличении температуры горючей смеси.
На рис.1.2. изображено распределение энергий между молекулами при температуре 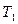 Если по оси энергий отметить значение, равное энергии активации
Если по оси энергий отметить значение, равное энергии активации 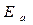 , то получим долю активных молекул в смеси при заданной температуре
, то получим долю активных молекул в смеси при заданной температуре 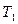 . Если под действием источника тепла температура смеси возросла до значения
. Если под действием источника тепла температура смеси возросла до значения  , то возрастет и доля активных молекул, а следовательно, и скорость реакции горения.
, то возрастет и доля активных молекул, а следовательно, и скорость реакции горения.
Однако существуют химические реакции, которые не нуждаются для своего развития в заметном предварительном подогреве. Это цепные реакции.
Основа теории цепных реакций – предположение о том, что исходные вещества превращаются в конечный продукт не сразу, а с образованием активных промежуточных продуктов
Продукт первичной химической реакции обладает большим запасом энергии, которая может рассеиваться в окружающем пространстве при соударении молекул продуктов реакции или за счет излучения, а может передаваться молекулам реагирующих компонентов, переводя их в активное состояние. Эти активные молекулы (атомы, радикалы) реагирующих веществ порождают цепь реакций, где энергия передается от одной молекулы к другой. Поэтому такие реакции называются цепными.

Химически активные молекулы, атомы, радикалы, образующиеся на элементарных стадиях цепной реакции – звеньях цепи- называются активными центрами. Большую часть активных центров составляют атомы и радикалы, которые наиболее реакционно способны. Но вследствие этого они и неустойчивы, т.к. могут вступать в реакции рекомбинации с образованием малоактивных продуктов.
Длина цепи, образуемая одним начальным активным центром, может достигать несколько сотен тысяч звеньев. Кинетические закономерности цепных реакций существенно зависят от того, сколько активных центров образуется в одном звене цепи. Если при участии исходного активного центра в результате образуется только один активный центр, то такая цепная реакция называется неразветвленной, если же в одном звене цепи образуются два или более активных центров, то такая цепная реакция называется разветвленной. Скорость разветвленных цепных реакций возрастает лавинообразно, в чем и состоит причина самоускорения химических реакций окисления при горении, так как для большинства из них характерен механизм разветвленных цепных реакций.
Практически любая реакция горения может иметь одновременно признаки и теплового и цепного механизма протекания реакции. Зарождение первых активных центров может иметь тепловой характер, а реагирование активных частиц по цепному механизму приводит к выделению тепла, разогреву горючей смеси и тепловому зарождению новых активных центров.
Любая цепная реакция складывается из элементарных стадий зарождения, продолжения и обрыва цепи.
Зарождение цепи является эндотермической реакцией. Образование свободных радикалов (т.е. атомов или групп атомов, имеющих свободные валентности, например, 
 ) из молекул исходных веществ возможно в результате мономолекулярного или бимолекулярного взаимодействия, а также в результате каких-либо посторонних воздействий на горючую смесь – инициирования.
) из молекул исходных веществ возможно в результате мономолекулярного или бимолекулярного взаимодействия, а также в результате каких-либо посторонних воздействий на горючую смесь – инициирования.
Инициирование может осуществляться путем добавки специальных вещест – инициаторов, легко образующих свободные радикалы (например, пероксидов, химически активных газов  ), под действием ионизирующих излучений, под действием света – фотохимическое инициирование. Например, взаимодействие водорода с хлором
), под действием ионизирующих излучений, под действием света – фотохимическое инициирование. Например, взаимодействие водорода с хлором
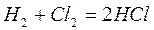
при обычных условиях протекает крайне медленно, а при сильном освещении (солнечным светом, горящим магнием) протекает со взрывом.
К реакциям продолжения цепи относятся элементарные стадии цепной реакции, идущие с сохранением свободной валентности и приводящие к расходованию исходных веществ и образованию продуктов реакции.
Примером разветвленной цепной реакции может служить реакция горения водорода в кислороде.
зарождение цепи:


разветвление цепи:

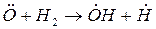
обрыв цепи:
гомогенный

гетерогенный


При развитии цепи, когда концентрация активных центров станет достаточно большой возможно образование такого звена, в котором активный центр прореагирует без генерации нового активного центра. Такое явление называется обрывом цепи.
Обрыв цепи может быть гомогенным и гетерогенным.
Гомогенный обрыв цепей возможен либо при взаимодействии радикалов или атомов между собой с образованием устойчивых продуктов, либо при реакции активного центра с посторонней для основного процесса молекулой без генерации новых активных центров.
Гетерогенный обрыв цепи происходит на стенках сосуда, где протекает реакция горения или поверхности твердых микрочастиц, присутствующих в газовой фазе, иногда специально вводимых (например, как при тушении порошками). Механизм гетерогенного обрыва цепей связан с адсорбцией активных центров на поверхности твердых частиц или материалов. Скорость гетерогенного обрыва цепей сильно зависит от соотношения площади поверхности стенок к объему сосуда, где происходит горение. Таким образом, уменьшение диаметра сосуда заметно снижает скорость реакции горения, вплоть до его полного прекращения. На этом основано создание огнепреградителей.
Примером разветвленной цепной реакции может служить реакция горения водорода в кислороде.
зарождение цепи:


разветвление цепи:

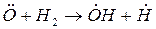
обрыв цепи:
гомогенный

гетерогенный


Горение углеводородов
Рассмотрение процессов горения водорода и оксида углерода показывает сложность механизма реакции горения. В случае Н2 и СО реакция протекает как цепная с участием множества элементарных стадий и промежуточных продуктов. Поэтому естественно ожидать, что механизм реакций горения более сложных по строению веществ - углеводородов еще более сложен и эффекты, сопровождающие процессы воспламенения и горения этих соединений более многообразны.
Имеющиеся в настоящее время сведения о природе химических превращений углеводородов в процессе их горения позволяют с некоторым приближением объяснить наблюдаемые эффекты.
Установлено, что в углеводородных пламенах, наряду с уже известными активными частицами Н×, ОН×, О× присутствует большое количество промежуточных продуктов более сложного строения. В ряде случаев они становятся источниками зарождения новых цепей. Основную роль в процессах воспламенения и горения углеводородов играют следующие типы промежуточных соединений:
1. Углеводородные радикалы, представляющие собой молекулу углеводорода, у которой удалены один или несколько атомов водорода. Эти остатки называются алкилами (СНз - метил; С2Н5 - этил; С3Н7 - пропил и т.д.). Из-за высокой реакционной способности алкилы в свободном виде длительно не существуют. Присутствуют в пламенах в виде промежуточных продуктов. При взаимодействии с другими молекулами ведут себя как самостоятельная структурная группа. Углеводородные радикалы
обычно изображают буквой R.
2. Перекиси - соединения общей формулы R-OO-R'.
3.Альдегиды - соединения типа
R – C = O
 H
H
Простейшими альдегидами являются муравьиный (формальдегид) HCOOH и уксусный (ацетальдегид) СН3СОН. Эти вещества всегда присутствуют в продуктах неполного сгорания углеводородов.
Зарождением цепи при горении углеводородов может стать любая реакция, в которой образуются углеводородные радикалы. Это может быть реакция разложения молекулы этана с образованием двух свободных метальных групп:
С2Н6 ® ×СН3
или реакция углеводорода с кислородом:
RH + O2 ® ×HO2 + ×R
Продолжение цепей происходит в результате реакций образования | перекисей или гидроперекиси:
R + O2 ® ROO×
ROO× + RH ® ROOH + R×
Разветвление цепей осуществляется при разложении гидроперекиси:
ROOH ® ×RO + ×OH
Приведенная последовательность реакций приводит к постепенному увеличению в реагирующей системе концентрации перекисных соединений.
Одновременно с накоплением перекисей, радикалов, ×OH и ×H начинают идти параллельные реакции:
 H2O + ×RO
H2O + ×RO
 ROOH + ×H
ROOH + ×H
H2 + ×ROO
и
ROOH + ×OH ® ROО× + Н2О
Эти реакции экзотермичны; при их протекании выделяется большое количество тепла.
При повышении температуры реагирующей смеси роль активных центров переходит от одних промежуточных продуктов к другим в следующем порядке: гидроперекиси алкилов, ацильные гидроперекиси, альдегиды.
Экспериментальные исследования изменения состава реагирующей смеси во времени в высокотемпературной области (600-800°С) показывают, что процесс превращения исходных углеводородов в конечные продукты горения СО2 и Н2О разделен на две стадии: на первой, протекающей с очень высокой скоростью, происходит окисление углеводородов до СО. На второй, медленной, стадии СО окисляется до СО2
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 4409; Нарушение авторских прав?; Мы поможем в написании вашей работы!