
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При горении
|
|
|
|
Влияние различных факторов на скорость химических реакций
Зависимость скорости реакции горения от концентрации реагирующих веществ можно представить выражением
 (1)
(1)
где: k0 – константа скорости реакции,
Сгор - концентрация горючего вещества, кмоль/м3,
Сок – концентрация окислителя, кмоль/м3,
x,y – порядки реакции по горючему и окислителю соответственно.
Как выше было сказано, суммарное уравнение реакции (1) не отражает истинного механизма протекания реакции горения, которая является многостадийной и, зачастую цепной, поэтому порядки реакции в уравнении (2) далеко не всегда совпадают с величиной стехиометрических коэффициентов в уравнении (1).
Отсюда следует, что чем больше концентрация горючего вещества, тем выше скорость горения.
Скорость реакции горения зависит от температуры:
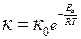 (3)
(3)
е – основание натурального логарифма
Еа – энергия активации, кДж/кмоль,
R – универсальная газовая постоянная, R=8,314 кДж/(К.кмоль)
Т – температура, К.
Это уравнение является выражением закона Аррениуса о зависимости скорости химических реакций от температуры. В упрощенном виде для узкого интервала температур можно пользоваться правилом Вант-Гоффа: скорость химической реакции возрастает в 2-4 раза при повышении температуры на каждые 100.
Таким образом, скорость химической реакции окисления горючего вещества при горении резко возрастает с повышением температуры, причем тем больше, чем ниже энергия активации.
Скорость реакций окисления при горении зависит также от давления.
Увеличение давления приводит к возрастанию объемной концентрации горючих газообразных веществ и окислителя. На практике это приводит к тому, что при увеличении давления скорость реакций горения большинства веществ увеличивается.
При высоких давлениях возникают горячие пламена.
Как отмечалось выше, химические реакции окисления высокоэкзотермичны, поэтому горение сопровождается выделением большого количества теплоты и следовательно протекает при высокой температуре. Например, температура горения древесины 700-8000С, нефтепродуктов – еще выше – 1300-15000С.
При низких давлениях могут возникать так называемые холодные пламена. Самоускорение цепной химической реакции горения при этом происходит в изотермическом режиме. Это происходит при определенном составе горючей смеси и определенном состоянии среды. Изотермическое самоускорение характерно для смесей с достаточно высокой концентрацией активных, но достаточно стабильных промежуточных продуктов, что приводит к уменьшению разветвления цепей, а следовательно и к уменьшению выделения теплоты, которая за счет теплоотвода рассеивается в окружающую среду и частично затрачивается на нагрев стабильных промежуточных продуктов. Возникает свечение, представляющее собой хемилюминесценцию, а не тепловое излучение нагретых продуктов горения, которое имеет место в горячих пламенах.
Кроме того, на возникновение холодных пламен большое влияние оказывают стенки сосуда, в котором происходит горение. Они оказывают каталитическое влияние на процесс уничтожения активных центров, т.е. происходит гетерогенный обрыв цепи. Интенсивность этого процесса определяется скоростью диффузии активных центров к стенкам сосуда. Понижение давления способствует этому процессу. Понижение давления может не только привести к образованию холодных пламен вместо горячих, но в определенных условиях (например, в узких сосудах) даже к полному прекращению горения.
Как отмечалось выше, химические превращения в процессе горения приводят к возникновению различных физических процессов: переносу тепла за счет конвекции, теплопроводности и излучения, переноса реагирующих веществ и др.
Таким образом, горение можно характеризовать как сложный самоподдерживающийся физико-химический процесс, для которого характерны три признака: химическое превращение, выделение тепла и излучение (в том числе чаще всего и световое, т.е. в видимой части спектра). Отсутствие какого-либо из указанных признаков свидетельствует о том, что рассматриваемый процесс к горению не относится, например, «горение» электрической лампочки (отсутствует химическое превращение), коррозия металлов (отсутствует выделение света и практически незначимым является выделение тепла) и т.п.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 2262; Нарушение авторских прав?; Мы поможем в написании вашей работы!