
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Простые и кратные углерод-углеродные связи
|
|
|
|
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА УГЛЕРОДА
Атом углерода во внешней электронной оболочке имеет 4 атомных орбитали:
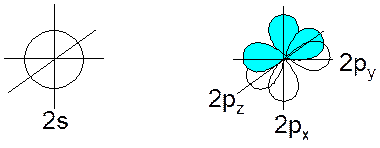
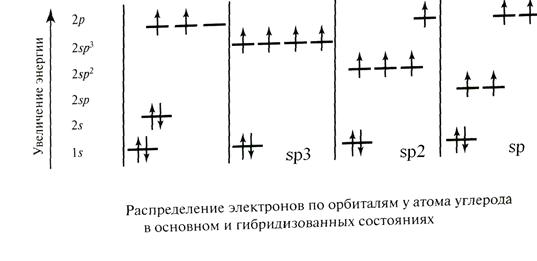
При образовании связей происходит т.н. гибридизация атомных орбиталей: несколько близких по энергии орбиталей как бы усредняются, образуя такое же количество орбиталей равных по энергии и отличающихся геометрической направленностью. Гибридные орбитали обеспечивают более полное перекрывание при образовании связей, и это делает гибридизацию энергетически выгодной.
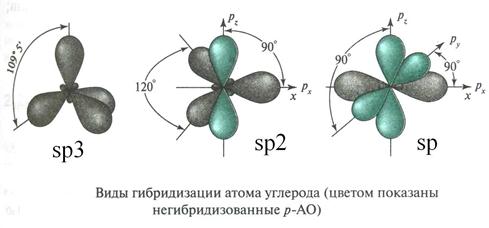
У атома углерода различаются три типа гибридизации:
· sp3 гибридизация, в ней участвует s-орбиталь и три р-орбитали;
· sp2 гибридизация: s-орбиталь и две р-орбитали;
· sp гибридизация: s-орбиталь и одна р-орбиталь.
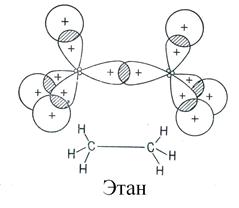
Простая (ординарная) σ-связь образуется путем осевого перекрывания гибридных орбиталей. Молекула этана имеет трехмерную (тригональную) геометрическую структуру:
Двойная связь образуется между двумя sp2-гибридизованными атомами и состоит из σ-связи, образованной осевым перекрыванием гибридных орбиталей, и π-связи, образованной боковым перекрыванием негибридизованных р-орбиталей. Молекула этилена имеет дигональную (планарную) геометрическую структуру - все σ-связи расположены в одной плоскости:
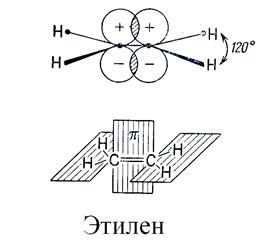
Тройная связь образуется между двумя sp-гибридизованными атомами и состоит из σ-связи и двух π-связей, причем плоскости π-связей перпендикулярны друг другу. Молекула ацетилена имеет линейную геометрическую структуру (все σ-связи находятся на одной прямой):
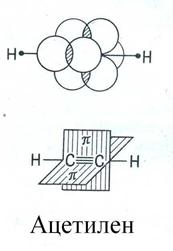
Длины связей уменьшаются в следующей последовательности:
ординарная > двойная > тройная
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 2386; Нарушение авторских прав?; Мы поможем в написании вашей работы!