
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
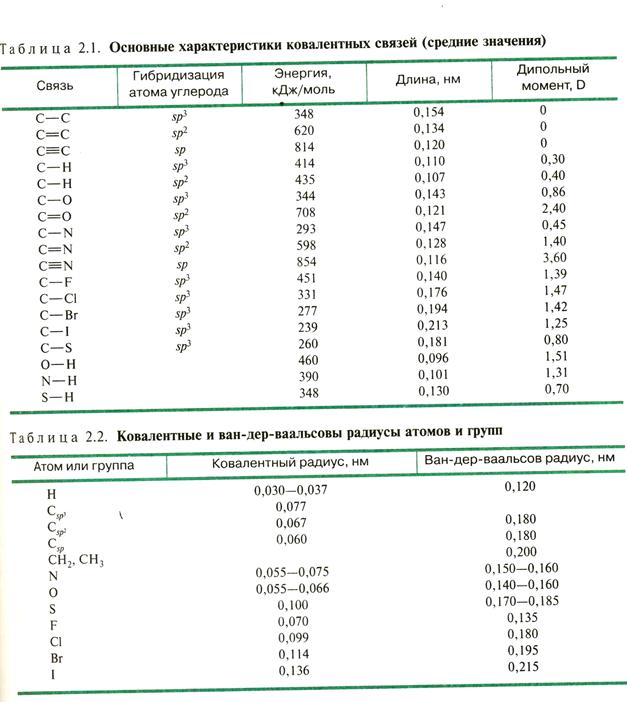
Характеристики ковалентной связи
|
|
|
|
МЕТОДЫ ОПИСАНИЯ ЭЛЕКТРОННОЙ СТРУКТУРЫ
Метод МО ЛКАО (Хюккель)
ψ = С1ψ1 + С2 ψ2 + С3ψ3 +... + Сnψn
ψ – молекулярная орбиталь
ψn – атомные орбитали
Этот метод применяется для расчетов энергетических параметров молекул и δ-зарядов на атомах.
Метод валентных схем
Применяется для описания структур, которые не могут быть однозначно описаны одной структурой. В основе метода лежит концепция мезомерии (К.Ингольд, 1922 г.) и теория резонанса валентных структур (Л.Полинг,1928 г.).
Примеры:

Донорно-акцепторная (координационная) связь – это ковалентная связь, образованная за счет пары электронов одного атома:
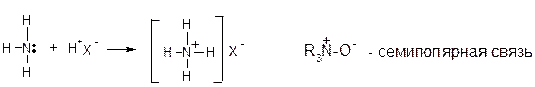
Координационные связи в комплексных соединениях:
комплексообразователь – лиганд
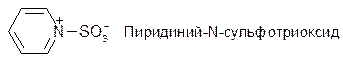
Донорами могут быть соединения с развитой системой π-электронов:
Длина связи – расстояние (в нм) между центрами связанных атомов,
определяется методом рентгено-структурного анализа (РСА).
Ковалентный радиус атома – равен ½ длины ковалентной связи между одинаковыми атомами.
Ван-дер-ваальсов радиус – равен ½ расстояния между максимально сближенными атомами. Всегда больше ковалентного радиуса.
Валентные углы – углы между осями орбиталей (см. геометрическую конфигурацию атомных орбиталей С-атома с различной гибридизацией).
Энергия связи (кДж/моль) – энергия, которую нужно затратить для разрыва связи. Равна энергии образования связи. Является мерой прочности связи.
Может быть косвенно определена по энергии сгорания вещества.
Энергия связи уменьшается с увеличением её длины.
Кратные связи короче и прочнее ординарных, но не пропорционально; т.е.
σ-связь прочнее π-связи.
Энергия связи между одними и теми же атомами зависит от структурных особенностей, например, она уменьшается в ряду:
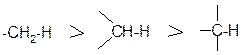
Полярность связи – смещение пары электронов, образующих связь, в сторону более электроотрицательного атома.
Электроотрицательность – способность атома притягивать электроны.
Электроотрицательность атомов (по Полингу):
| F | O | N | Cl | Br | I | C | S | H | Mg | Li | Na |
| 4,0 | 3,5 | 3,0 | 3,0 | 2,8 | 2,6 | 2,5 | 2,5 | 2,1 | 1,2 | 1,0 | 0,9 |
Электроотрицательность углерода:
| sp3 | sp2 | sp |
| 2,5 | 2,8 | 3,1 |
Дипольный момент – мера полярности связи:
μ = q·l
q – заряды на атомах (абсолютная величина)
l – длина связи
Для многоатомных молекул μ определяется как векторная сумма дипольных моментов всех связей.
Молекулы, содержащие высокополярные связи могут быть в целом неполярны: СО2, CCl4.
Поляризуемость связи – способность к динамическому смещению электронов под действием электромагнитного поля (воздействие приближающейся активной частицы или молекул растворителя). Определяет реакционную способность связи в значительной степени.
Поляризуемость увеличивается с увеличением длины связи, например:
С-O (1) C—S (2)
у (1) стационарный диполь больше, чем у (2), но в динамических условиях реакции легко поляризуемая (2) более реакционноспособна.
Поляризуемость π-связи значительно больше, чем σ-связи.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 601; Нарушение авторских прав?; Мы поможем в написании вашей работы!