
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Снятие с производства
|
|
|
|
Производство
Перенос технологии
- Из НИОКР в производство (масштабирование)
- С одной площадки на другую
- Закупка оборудования и материалов
- Технологический процесс
- Контроль и обеспечение качества
- Выпуск, хранение, распределение
- Сохранение документации и образцов
- Продолжение оценки продукта
Основы правил надлежащего производства лекарственных препаратов (надлежащая производственная практика).
Правила надлежащего производства являются той частью управления качеством, которая гарантирует, что продукцию постоянно производят и контролируют по стандартам качества, соответствующим ее предназначению, а также в соответствии с требованиями регистрационного досье, протокола клинических исследований и спецификации на эту продукцию.
Правила надлежащего производства связаны как с производством, так и с контролем качества.
Основные требования GMP:
1) все производственные процессы должны быть четко определены, периодически пересматриваться с учетом накопленного опыта, и должна демонстрироваться способность постоянно производить лекарственные препараты требуемого качества в соответствии со спецификациями на них;
2) критические стадии производственного процесса и существенные изменения процесса должны пройти валидацию;
3) должны быть обеспечены все необходимые условия для выполнения требований GMP, включая наличие:
• надлежащим образом обученного персонала, имеющего необходимую квалификацию;
• соответствующих помещений и площадей;
• соответствующих оборудования и системы обслуживания;
• соответствующих сырья, упаковочных и маркировочных материалов (далее – материалы);
• утвержденных процедур и инструкций в соответствии с фармацевтической системой качества;
• соответствующих условий хранения и транспортирования;
4) инструкции и процедуры должны быть изложены в письменной форме ясно и недвусмысленно, они должны быть конкретно применимы к имеющимся в наличии средствам;
5) персонал должен быть обучен правильному выполнению процедур;
6) в процессе производства следует составлять протоколы (рукописным способом и/или с применением технических средств), документально подтверждающие фактическое проведение этапов, требуемых установленными методиками и инструкциями, а также что количество и качество продукции соответствуют установленным нормам.
7) любые существенные отклонения должны быть полностью оформлены документально и расследованы с целью определения причины отклонения и осуществления соответствующих корректирующих и предупреждающих действий;
8) протоколы производства, включая документацию по реализации, позволяющие проследить исчерпывающую историю серии, следует сохранять в понятной и доступной форме;
9) при оптовой реализации продукции необходимо свести к минимуму риски для ее качества и учитывать правила оптовой торговли лекарственными средствами для медицинского применения;
10) должна быть в наличии система отзыва любой серии продукции из продажи или поставки;
11) следует рассматривать претензии на продукцию, расследовать случаи брака и принимать соответствующие меры как в отношении бракованной продукции, так и для предотвращения подобных случаев.
Всемирное развитие GMP. Мировая сеть GMP. Испектораты по GMP.
Механизмы международногосотрудничества:
ВОЗ (Всемирная организация здравоохранения)
Европейский союз
Совет Европы
Конференция по гармонизации (ICH)
Конвенция по фарминспекциям (PIC-PIC/S)
Международнпя фармацевтическая федерация (FIP)
ИСО (Международная организация по стандартизации)
ВТО (Всемирная торговая организация)
Ключевые аспекты взаимоотношения системы контроля качества и обеспечения качества.
Итак, основное требование стандарта GMP – наличие системы обеспечения качества у производителя лекарственных препаратов. Система эта включает правила надлежащей производственной практики, контроль качества лекарств и управление рисками качества. Обратите внимание, что вся деятельность в рамках системы должна быть документирована (отражена в документах). Также налицо требование оценивать эффективность этой работы, то есть должны быть параметры процессов, показатели, демонстрирующие, что система находится под контролем. Важное требование – участие различных подразделений организации, поставщиков и дистрибьюторов в деятельности по обеспечении качества, то есть это задача не только отдела или службы качества!
Контроль качества включает в себя отбор проб, проведение испытаний и проверок на соответствие требованиям спецификаций, инструкций и других документов, организацию работы, документальное оформление и выдачу разрешений на выпуск. Цель контроля качества – не допустить к использованию или реализации материалы или продукцию, не удовлетворяющие установленным требованиям.
Основные требования к контролю качества:
i. должны быть в наличии соответствующие помещения и оборудование, обученный персонал и утвержденные методики для отбора проб, контроля и испытаний исходных материалов, промежуточной, нерасфасованной и готовой продукции, а также, при необходимости, для мониторинга условий производственной среды в целях выполнения GMP;
ii. отбор проб исходных материалов, промежуточной, нерасфасованной и готовой продукции должен осуществляться утвержденным персоналом и утвержденными методами;
iii. методы испытаний должны пройти валидацию;
iv. должны быть составлены протоколы (рукописным способом и/или с помощью записывающего устройства), документально подтверждающие, что все необходимые мероприятия по отбору проб, контролю и методикам испытаний действительно проведены. Любые отклонения должны быть полностью оформлены документально и расследованы;
v. готовая продукция должна содержать активные (фармацевтические) субстанции, соответствующие регистрационному досье по качественному и количественному составу;
она должна иметь требуемую чистоту, должна быть вложена в надлежащую упаковку и правильно маркирована;
vi. документы, оформленные по результатам контроля и испытаний материалов, промежуточной, нерасфасованной и готовой продукции, должны быть официально сопоставлены с требованиями спецификаций. Оценка продукции должна включать обзор и оценку соответствующей производственной документации и оценку отклонений от установленных процедур;
vii. ни одна серия продукции не может быть разрешена для продажи или поставки до того, как Уполномоченное лицо не удостоверит ее соответствие требованиям, установленным при государственной регистрации в соответствии с Приложением 16 Руководства по GMP;
viii. необходимо сохранять достаточное количество контрольных образцов исходного сырья и продукции, которое позволит проводить испытания продукции в будущем (при необходимости) в соответствии с Приложением 19 Руководства по GMP; образцы в этом случае следует хранить в окончательной упаковке.
На предприятии по производству лекарств должна быть система обеспечения фармацевтического качества (Директива Еврокомиссии 2003/94/ЕС от 8 октября 2003, преамбула, п.7).
Качество ЛС это:
-соответствие официальным требованиям
- пригодность продукта в клинике (для пациента)
- устойчивость процессов и свойств продукта
Качественный лекарственный продукт – это такой продукт, каждая единица каждой серии которого способна оказать предсказуемое лечебное (профилактическое) действие, соответствующее предписанию врача или инструкции по применению
Отличие понятия “ Обеспечение качества” от понятия “ контроля качества ”: конечный результат “контроля качества” сводится к отделению плохой части продукции от хорошей. “Контроль качества” всегда обращен в прошлое. “Обеспечение качества”, полностью включая в себя понятие “контроль качества” в виде одного, не самого главного компонента, нацелено на профилактику дефектов и потому обращено в основном в будущее. Обеспечение качества – профилактика ошибок и отклонений путем соблюдения всех требований, в первую очередь внутренних.
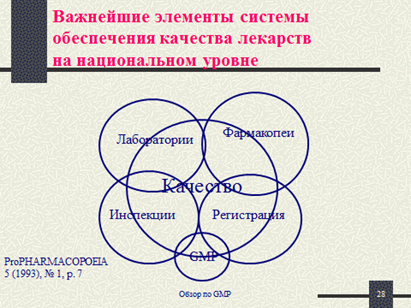
Международная фармакопея ВОЗ об обеспечении качества ЛС:
- Фармакопейные спецификации представляют собой лишь один из элементов современной системы обеспечения качества ЛС.
- Необходимо соблюдать текущие (т.е. не устаревшие) правила GMP в производстве фармацевтических субстанций и дозированных форм.
- Используемые при этом процессы, помещения, оборудование и т.п. должны соответствовать условиям регистрации продуктов.
Система качества
• Система качества = менеджмент качества = управление качеством = обеспечение качества
• Координирует все виды деятельности организации, относящиеся к качеству продукции
• Координирует процессы и методики внедрения, контроля и улучшения качества
• Применяется для контроля, обеспечения и повышения эффективности процессов, используемых для предоставления качественного продукта (или услуги)
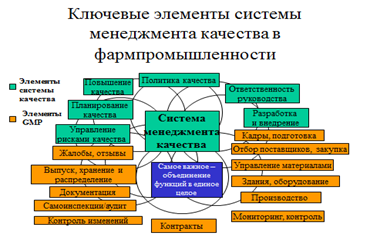
Итак, для обеспечения качества должны осуществляться следующие мероприятия:
- учет требований GMP еще на этапе разработки препарата,
- все процессы по изготовлению препарата описаны, конкретные количественные требования к этим процессам изложены в документации,
- определено, кто за что отвечает,
- нужно использовать подходящие по требованиям сырье и упаковку для производства препарата,
- нужно определить, какой контроль нужен в процессе изготовления препарата и осуществлять этот контроль, такое же требование и к валидации (проверке годности оборудования, установки нового оборудования и годности новых процессов),
- готовая продукция должна быть проверена в соответствии с заранее установленными методиками,
- нельзя продавать партию препарата, пока так называемое «уполномоченное лицо», отдельный назначенный для этой цели ответственный сотрудник (руководитель) не утвердит продажу этой препарата. Он отвечает (в том числе и юридически) за выполнение всех действий по проверке качества и годности этой партии.
- должна осуществляться проверка стабильности и сохранения свойств препарата, которая подтверждает сохранение свойств в течение всего срока годности, о котором заявил производитель,
- на предприятии должны проводиться внутренние проверки системы качества.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 666; Нарушение авторских прав?; Мы поможем в написании вашей работы!