
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворами кислот и щелочей
|
|
|
|
Рассмотрим взаимодействие типичных восстановите-лей, металлов, с некоторыми окислителями - водой, раство-рами кислот и щелочей. Необходимое условие осуществления реакции окисления металла - 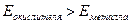 .
.
Окислительно-восстановительные потенциалы некото-рых металлов, водорода и кислорода в кислой, нейтральной и щелочной среде приведены в таблице.
| Среда | |||||
| кислая (рН=0) | нейтральная (рН=7) | щелочная (рН=14) | |||
| окисл.-восст. пара | Е0, В | окисл.-восст. пара | Е, В | окисл.-восст. пара | Е0, В |
| 2H+/H2 | 2H2O/H2 | -0,41 | 2H2O/H2 | -0,83 | |
| O2/2H2O | +1,22 | O2/4OH- | +0,81 | O2/4OH- | +0,40 |
| Al3+/Al | -1,66 | Al(OH)3/Al | -1,88 | AlO2-/Al | -2,36 |
| Bi3+/Bi | +1,21 | BiO+/Bi | -0,04 | Bi2O3/Bi | -0,45 |
| Cd2+/Cd | -0,40 | Cd(OH)2/Cd | -0,41 | Cd(OH)2/Cd | -0,82 |
| Co2+/Co | -0,28 | Co(OH)2/Co | -0,32 | Co(OH)2/Co | -0,73 |
| Cr3+/Cr | -0,74 | Cr(OH)3/Cr | -0,93 | CrO2-/Cr | -1,32 |
| Cu2+/Cu | +0,34 | Cu(OH)2/Cu | +0,19 | Cu(OH)2/Cu | -0,22 |
| Fe2+/Fe | -0,44 | Fe(OH)2/Fe | -0,46 | Fe(OH)2/Fe | -0,87 |
| Mg2+/Mg | -2,36 | Mg(OH)2/Mg | -2,38 | Mg(OH)2/Mg | -2,69 |
| Ni2+/Ni | -0,25 | Ni(OH)2/Ni | -0,30 | Ni(OH)2/Ni | -0,72 |
| Pb2+/Pb | -0,13 | Pb(OH)2/Pb | -0,14 | PbO22-/Pb | -0,54 |
| Sn2+/Sn | -0,14 | Sn(OH)2/Sn | -0,50 | SnO22-/Sn | -0,91 |
| Zn2+/Zn | -0,76 | Zn(OH)2/Zn | -0,81 | ZnO22-/Zn | -1,22 |
Реальное прохождение реакции, помимо соотношения потенциалов окислителя и восстановителя, определяет кинетика процесса. Взаимодействие металлов с окислителями в отдельных случаях тормозится оксидными или солевыми плёнками на поверхности металла. Такое состояние металла называют пассивным, а явление перехода в пассивное состояние - пассивацией.
Действие кислот на металлы
Кислоты можно разбить на две группы:
· кислоты, в которых окислителем являются ионы водорода (хлороводородная - соляная, разбавленная серная и др.),
· кислоты, в которых окислителем служат анионы, содержащие элементы, в высшей степени окисления - 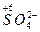 ,
, 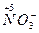 (концентрированная серная, азотная.).
(концентрированная серная, азотная.).
· Взаимодействие металлов с кислотами, в которых окислитель - ион водорода
В растворах таких кислот стандартный потенциал окислителя 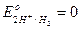 , т.е. с ними реагируют металлы с положительными значениями потенциалов (стоящие в ряду напряжений левее водорода).
, т.е. с ними реагируют металлы с положительными значениями потенциалов (стоящие в ряду напряжений левее водорода).
Пример 1. Zn + H 2SO4 разб. ®
в-ль ок-ль
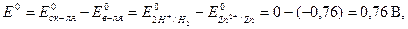
цинк растворяется в разбавленной серной кислоте:
Zn - 2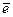 = Zn2+
= Zn2+
 2H+ + 2
2H+ + 2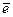 = H2
= H2
Zn + 2H+ = Zn2+ + H2
Zn + H2SO4 разб. = ZnSO4 + H2.
Пример 2. Cu + H 2SO4 разб. или H Cl ®
в-ль ок-ль ок-ль
Реакция взаимодействия меди с хлороводородной (соляной) и разбавленной серной кислотами невозможна, так как потенциал окислителя меньше потенциала восстановителя:
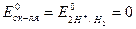 ;
; 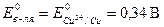 .
.
· Взаимодействие металлов с кислотами, в которых окислитель - анион кислоты.
В концентрированной серной и разбавленной азотной кислотах продукты восстановления аниона зависят от активности металла.
По активности металлы можно условно разделить на три группы:
Li Ba Ca Na Mg Al Mn Zn Cr Fe Cd Ni Sn Pb H Bi Cu Ag Hg Au
¬¾¾¾¾¾¾¾¾® ¬¾¾¾¾¾¾¾® ¬¾¾¾¾¾®
активные средней активности малоактивные
Взаимодействие металлов с H2SO4 конц.
При взаимодействии металлов с концентрированной серной кислотой сульфат-ион может восстанавливаться до H2S, S, SO2. Условная схема взаимодействия металлов с концентрированной серной кислотой может быть представлена следующим образом:

 М активные H2S
М активные H2S
М средн. активности
 М + H2SO4конц. ® сульфат М + H2O + S
М + H2SO4конц. ® сульфат М + H2O + S
М малоактивные
 SO2
SO2
Пример. Mn + H2SO4 конц.®
Марганец – активный металл, поэтому при взаимодействии образуется H2S:
 4 Мn - 2
4 Мn - 2 = Мn2+
= Мn2+
 SO42- + 8
SO42- + 8 + 10H+ = H2S + 4H2O
+ 10H+ = H2S + 4H2O
4Mn + SO42- + 10H+ = 4Mn2+ + H2S + 4H2O

 4SO42- 4SO42-
4SO42- 4SO42-
4Mn + 5H2SO4конц. = 4MnSO4 + H2S + 4H2O.
Серная кислота в данной реакции - не только окисли-тель, но и среда, в которой проходит ОВР.
Взаимодействие металлов с HNO3
При взаимодействии металлов с разбавленной азотной кислотой нитрат-ион также может восстанавливаться до разных продуктов - NH4+, N2, N2O, NO.
Условная схема взаимодействия металлов с разбавленной азотной кислотой:

 М активные NH4NO3
М активные NH4NO3
М ср. акт.
 М + HNO3 разб. ® нитрат М + H2O + N2, N2O
М + HNO3 разб. ® нитрат М + H2O + N2, N2O
М малоакт.
 NO
NO
Пример. Cu + HNO3 разб. ®
Медь – малоактивный металл, 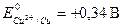 , поэтому при взаимодействии с разбавленной азотной кислотой образуется NO:
, поэтому при взаимодействии с разбавленной азотной кислотой образуется NO:
 3 Cu - 2
3 Cu - 2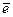 = Cu2+
= Cu2+
2 NO3- + 3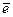 + 4H+ = NO + 2H2O
+ 4H+ = NO + 2H2O
 |

 3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO + 4H2O
3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO + 4H2O
6NO3- 6NO3-
3Cu + 8HNO3разб. = 3Cu(NO3)2 + 2NO + 4H2O.
В реальных условиях при реакциях с концентрированной серной и разбавленной азотной кислотами, как правило, образуется смесь продуктов восстановления анионов, в которой количественно преобладает тот или иной компонент. Состав смеси во многом определяется концентрацией раствора кислоты. Так, например, действие на металлы сильно разбавленной азотной кислоты приводит к появлению в продуктах реакции нитрата аммония.
При взаимодействии металлов с концентрированной азотной кислотой, независимо от активности металла, образуется NO2:
М + HNO3конц. ® нитрат М + NO2 + H2O.
Пример. Zn + HNO3 конц. ®
 Zn - 2
Zn - 2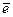 = Zn2+
= Zn2+
 2 NO3- +
2 NO3- + 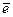 + 2H+ = NO2 + H2O
+ 2H+ = NO2 + H2O
Zn + 2NO3- + 4H+ = Zn2+ + 2NO2 + 2H2O

 2NO3- 2NO3-
2NO3- 2NO3-
Zn + 4HNO3 конц. = Zn(NO3)2 + 2NO2 + 2H2O.
Концентрированные кислоты, в частности, серная и азотная, на некоторые металлы оказывают пассивирующее действие. В результате многие металлы не растворяются в таких кислотах. К примеру, с концентрированной серной кислотой при комнатной температуре не реагирует железо. Вследствие перехода металла в пассивное состояние при реакциях с рассматриваемой группой кислот могут образоваться продукты, не соответствующие приведенным схемам. Например, при нагревании железо реагирует с концентрированной серной кислотой, но образуется продукт восстановления SO2, более характерный для реакций с участием малоактивных металлов.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1120; Нарушение авторских прав?; Мы поможем в написании вашей работы!