
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимодействие металлов с растворами щелочей
|
|
|
|
Взаимодействие металлов с водой
Реакции взаимодействия металлов с водой в общем виде описываются схемой
M + H2O ® M(OH)n + H2.
в-ль ок-ль
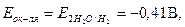
следовательно, реагировать с водой могут те металлы, потенциал которых менее -0,41 B. Практически в воде раство-ряются щелочные и щелочноземельные металлы, а такие металлы как алюминий, цинк, хром, титан с водой не реагируют из-за явления пассивации.
Пример. Ca + H2O ®
в-ль ок-ль
Потенциал кальция вследствие растворимости гидроксида может быть принят равным стандартному потенциалу:
 ,
, 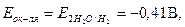
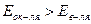 , кроме того, гидроксид кальция частично растворим в воде, поэтому кальций (щелочноземельный металл) растворяется в воде:
, кроме того, гидроксид кальция частично растворим в воде, поэтому кальций (щелочноземельный металл) растворяется в воде:
 Сa - 2
Сa - 2 = Ca2+
= Ca2+
2H2O + 2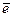 = H2 + 2 OH-
= H2 + 2 OH-
 |
Сa + 2H2O = Ca2+ + H2 + 2OH-
Ca + 2H2O = Ca(OH)2 + H2.
В растворах щелочей окислительное действие оказывают также молекулы воды, но с увеличением pH окислительная способность воды уменьшается, при pH = 14 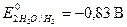 . Другое отличие поведения металлов в растворах щелочей обусловлено растворением пассивиру ющих плёнок на металлах, оксиды которых амфотерны. Таким образом, в растворах щелочей растворяются металлы, потенциалы которых меньше -0,83В, а оксиды и гидроксиды амфотерны.
. Другое отличие поведения металлов в растворах щелочей обусловлено растворением пассивиру ющих плёнок на металлах, оксиды которых амфотерны. Таким образом, в растворах щелочей растворяются металлы, потенциалы которых меньше -0,83В, а оксиды и гидроксиды амфотерны.
Пример. Al + NaOH + H2O ®
в-ль ок-ль
В водных растворах щелочей роль окислителя выполняет вода, 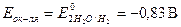 . Выписываем потенциал алюминия в щелочной среде:
. Выписываем потенциал алюминия в щелочной среде: 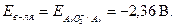 Реакция взаимодействия алюминия с раствором щёлочи возможна,
Реакция взаимодействия алюминия с раствором щёлочи возможна, 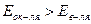 . Другим условием взаимодействия является растворимость гидроксида и оксида металла в растворе щёлочи, это условие выполняется, так как оксид и гидроксид алюминия амфотерны. Таким образом, алюминий реагирует с раствором едкого натра:
. Другим условием взаимодействия является растворимость гидроксида и оксида металла в растворе щёлочи, это условие выполняется, так как оксид и гидроксид алюминия амфотерны. Таким образом, алюминий реагирует с раствором едкого натра:
 2 Al - 3
2 Al - 3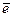 + 4OH- = AlO2- + 2H2O
+ 4OH- = AlO2- + 2H2O
 3 2H2O + 2
3 2H2O + 2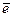 = H2 + 2OH-
= H2 + 2OH-
2Al + 8OH- + 6H2O = 2AlO2- + 4H2O + 3H2 + 6OH-

 2Al + 2OH- + 2H2O = 2AlO2- + 3H2,
2Al + 2OH- + 2H2O = 2AlO2- + 3H2,
2Na+ 2Na+
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2.
Выше рассмотрены лишь общие закономерности взаимодействия металлов с водой, растворами кислот и щелочей. При анализе поведения металла в той или иной среде необходимо также учитывать его индивидуальные особенности.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 400; Нарушение авторских прав?; Мы поможем в написании вашей работы!