
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При электрохимической коррозии
|
|
|
|
При электрохимической коррозии выделяют два взаимосвязанных процесса: анодный и катодный.
· Анодный процесс – окисление металла, происходит на участках изделий с меньшим потенциалом в данной среде. Анодные участки разрушаются.
· Катодный процесс – восстановление окислителя, находящегося в растворе или расплаве электролита, происходит на участках изделий с большим потенциалом в данной среде. Катодные участки химически не изменяются. Они служат проводниками электронов от анодных участков к окислителю, чем усиливают коррозию анодных участков. Более подробно это будет рассмотрено далее на конкретных примерах.
Окислители при коррозии принято называть деполяризаторами. Коррозию с участием наиболее распространённых окислителей - растворённого кислорода и ионов водорода (кислоты или воды) соответственно называют коррозией с кислородной и водородной деполяризацией. Уравнения катодных процессов при коррозии с водородной и кислородной деполяризацией приведены в таблице.
| Уравнения катодного процесса | |
| в отсутствие растворенного кислорода (с водородной деполяризацией) | в присутствии растворенного кислорода (с кислородной деполяризацией) |
| кислая среда | |
 (1) (1)
|  (3) (3)
|
| нейтральная и щелочная среда | |
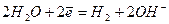 (2) (2)
| 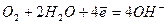 (4) (4)
|
Окислительно-восстановительные потенциалы кислоро-да и водорода в различных средах (точнее, соответствующих окислительно-восстановительных пар) приведены в таблице. Ранее отмечали: чем больше значение потенциала окислитель-но-восстановительной пары, тем более сильным окислителем является окисленная форма (Ок) данной пары. Поэтому окислительные свойства кислорода выше окислительных свойств иона водорода (или воды). Известно, что при рН³7, т.е. в нейтральных и щелочных растворах, процесс обычно протекает с кислородной деполяризацией - уравнение (4), в кислых средах – преимущественно с водородной деполяризацией - уравнение (1). На практике окислителями одновременно могут выступать и ионы водорода, и кислород, т.е. процесс может проходить с водородно-кислородной деполяризацией.
Коррозия, как и любой окислительно-восстановитель-ный процесс, может осуществляться только в тех случаях, когда потенциал окислителя больше потенциала восстано-вителя - металла анодных участков:
 .
.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 475; Нарушение авторских прав?; Мы поможем в написании вашей работы!