
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы защиты металлов от коррозии
|
|
|
|
Решение.
· 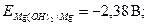
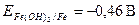 .
.
· Анодный участок гальванопары - металл с меньшим потенциалом, Mg (восстановитель в процессе коррозии).
· Катодный участок гальванопары - металл с более высоким значением потенциала - Fe. На поверхности железа происходит восстановление окислителя.
· Окислитель при коррозии с кислородной деполяризацией - кислород, 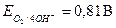 .
.
· 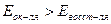 , коррозия возможна.
, коррозия возможна.
· Электронно-ионная схема реакции:
 |
2 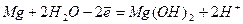 - анодный процесс
- анодный процесс
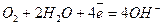 - катодный процесс (на Fe)
- катодный процесс (на Fe)
 |
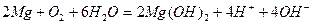 .
.

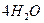
· Молекулярное уравнение: 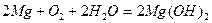 .
.
· Изоляция металла от коррозионной среды.
· Неметаллические покрытия:
лаки, краски, эмали, битум, пластмассы, керамика, резина, смолы и другие покрытия, наносимые физическими способами;
оксидные, фосфатные и другие пленки, получаемые обработкой металла химическими веществами.
· Металлические покрытия:
анодные покрытия – покрытия изделия более активным металлом, то есть металлом с меньшим потенциалом в данной среде, чем потенциал покрываемого металла, пример - оцинкованное железо;
катодные покрытия – покрытия изделия менее активным металлом, то есть металлом с большим потенциалом в данной среде, чем потенциал покрываемого металла; примеры - меднение, никелирование стали.
Схемы процессов, происходящих в порах или при нарушении сплошности металлических покрытий, приведены на рисунке:
 |  |  |  |  |  | ||||||||||||||
 |  |  |  |










 H2 H2
H2 H2
 Zn2+ Zn2+
Zn2+ Zn2+
 H+ Fe2+ H+ H+ H2
H+ Fe2+ H+ H+ H2
 |  |  |  |
Ni(K) Ni(K) Zn(A) Zn(A)
 |  |
Fe(A) Fe(K)
катодное покрытие анодное покрытие
Анодные покрытия более надёжно защищают металл основы от коррозии. Основное требование к катодным покрытиям - высокая механическая прочность покрытия и коррозионная стойкость металла покрытия. К примеру, покрытия никелем используют для защиты от коррозии и для декоративной отделки деталей автомобилей, велосипе-дов, приборов, предметов домашнего обихода и т.д. Никель отличается высокой коррозионной стойкостью на воздухе, в растворах щелочей и некоторых кислот благо-даря сильно выраженной склонности к пассивации. При изменении состава коррозионной среды может меняться и характер покрытия. Так, из сравнения стандартных потенциалов олова и железа при рН=0 следует, что олово является катодом по отношению к железу. Однако в среде органических кислот, содержащихся во многих пищевых средах, олово образует с ними комплексные соединения, и потенциал его становится более отрицательным. В этих условиях олово является анодным покрытием по отношению к железу. Соединения олова малотоксичны, поэтому его используют в производстве белой жести для консервной промышленности.
· Уменьшение агрессивности среды.
Введение ингибиторов – специальных химических соединений, замедляющих коррозию. Ингибиторы подбирают индивидуально для конкретных металлов с учетом характера среды.
Деаэрация – удаление из воды растворённого кислорода (осуществляется кипячением, пропусканием нагретой воды через стальную стружку и т.д.).
· Электрохимическая защита.
· Протекторная защита:
к защищаемой металлической конструкции прикрепляют более активный металл, который окисляется, предохраняя конструкцию от разрушения. Прикрепляемый металл выполняет роль протектора (защитника) по отношению к металлической конструкции. Пример: для протекторной защиты изделий из стали в подземных условиях используют сплавы на основе магния, алюминия, цинка.
Схема протекторной защиты:
 | |||
 |
 протектор
протектор
 |
 почвенная
почвенная

 вода
вода
· Катодная защита.
При катодной защите используют внешний источник постоянного тока. Защищаемую конструкцию (трубопро-воды, рельсы) присоединяют к отрицательному полюсу ис-точника тока (к катоду). Положительный полюс источника тока присоединяют к металлическому лому, находящемуся в той же коррозионной среде. Принцип катодной защиты основан на смещении равновесия окисления металла
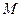 <==>
<==> 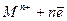
влево, схема катодной электрозащиты изображена на рисунке:

 к сети
к сети
 |

 K(–) A(+)
K(–) A(+)
 |
защищаемая

 конструкция
конструкция

 лом
лом
 почвенная
почвенная

 вода
вода
· Легирование металлов.
· Рациональное конструирование элементов металлических аппаратов и сооружений.
Коррозия металлов происходит, в большей или меньшей степени, всюду, где эксплуатируют металлические изделия и конструкции. В каждом случае приходится проводить специальные исследования по коррозии и выбору эффективного способа защиты.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 382; Нарушение авторских прав?; Мы поможем в написании вашей работы!