
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Парциальные молярные величины
|
|
|
|
Введение
Тема 6. Растворы
Исследование растворов – важная область физической химии, поскольку как в природе, так и в технике нам постоянно приходиться иметь дело с растворами, а не с чистыми веществами. Например, получаемые в современной технике методами вакуумной и зонной плавок чистейшие металлы все же содержат ничтожные количества (10–6 %) примесей, главным образом металлоидов, и по существу являются растворами.
Большая часть процессов, протекающих в природе, а также лежащих в основе различных технологических процессов, протекают в жидкой фазе. Так химические реакции при выплавке чугуна и стали происходят преимущественно в растворах. Жидкие чугун и сталь представляют собой растворы различных элементов в железе. В доменных и сталеплавильных печах они взаимодействуют с жидким шлаком – раствором оксидов.
Водные растворы солей, кислот и оснований широко используются в гидрометаллургии при извлечении цветных металлов из руд.
Раствором называется однородная, гомогенная система переменного состава, состоящая из двух или более компонентов. Растворы могут существовать в любом агрегатном состоянии – твердом, жидком или газообразном. Общим признаком их является однофазность.
Растворы весьма разнообразны по своей природе и по характеру взаимодействия между частицами их компонентов. Так, например, раствор серной кислоты в воде, образующийся с выделением большого количества тепла, характеризуется отчетливо выраженным химическим взаимодействием, а в растворе сжиженных благородных газов – аргона и неона – действуют физические силы. Во многих реальных растворах природа взаимодействия между частицами настолько сложна, что невозможно отделить ее химическую и физическую стороны.
Компонентами раствора являются растворитель (среда) и растворенное вещество (или несколько веществ), равномерно распределенных в растворителе в виде молекул, атомов или ионов. Под растворителем обычно понимают то вещество, которое находится в таком же агрегатном состоянии, что и раствор в целом. Если агрегатное состояние веществ, составляющих раствор, одинаковое, то растворителем называют то из них, которое преобладает в данной системе. Например, в 5%-ном растворе сахара в воде последняя является растворителем, а сахар – растворенным веществом. В целом понятия «растворитель» и «растворенное вещество» имеют до некоторой степени условный характер. Например, в концентрированных растворах различие между растворенным веществом и растворителем менее очевидно. Для 50%-ного раствора этилового спирта и воды понятия равноправны, а для раствора, в котором содержится 95 % спирта и 5 % воды, последняя является растворенным веществом. Поэтому понятия «растворитель» и «растворенное вещество» целесообразно использовать в применении к разбавленным (неконцентрированным) растворам. Для растворов электролитов вода всегда является растворителем, даже если ее и очень мало.
Состав раствора или его концентрацию выражают различными способами. Наиболее удобно выражать концентрацию раствора в мольных долях.
Молярная доля Ni – отношение числа молей i -го вещества (ni) к общему числу молей всех компонентов в данном количестве раствора Σ ni:
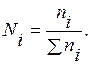 (6.1)
(6.1)
В случае водных растворов концентрацию обычно выражают числом число молей растворенного вещества в 1 л раствора – молярная концентрация (С м):
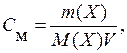 (6.2)
(6.2)
где V – объем раствора, дм3.
Однако, использование молярной концентрации не всегда удобно, так как концентрация раствора вследствие термического расширения зависит от температуры. В связи с этим часто также пользуются моляльностью. Моляльность (Cm) – число молей растворенного вещества в 1000 г растворителя:
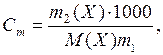 (6.3)
(6.3)
где m2(X) – масса растворенного вещества, г; М(X) – молярная масса растворенного вещества, г/моль; m 1 – масса растворителя, г.
Между молярной долей и моляльностью в водных растворах существует соотношение
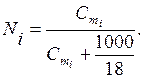 (6.4)
(6.4)
Вещество, переходя в раствор, становится компонентом раствора, теряет свою индивидуальность.
Свойства раствора могут быть охарактеризованы термодинамическими величинами V, H, U, F, G и т.д. Вследствие взаимодействия между молекулами компонентов раствора термодинамические характеристики имеет смысл относить к раствору как к целому, а не к составляющим его веществам. Так, раствор характеризуется вполне определенным, поддающимся простому измерению объемом, однако нельзя определить, какие объемы занимают в нем отдельные компоненты.
В каком либо растворе, например растворе серной кислоты в воде, наряду с энергией молекул серной кислоты и воды имеет место энергия взаимодействия между этими веществами, которая характеризует раствор и не может быть отнесена к какому-либо из компонентов. Однако все же важно охарактеризовать, какую долю вносит данный компонент в то или иное свойство раствора. Такая характеристика называется парциальной величиной.
Г. Льюис назвал парциальной молярной величиной компонента частную производную от какой-либо экстенсивной величины g по числу молей 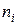 этого компонента раствора при постоянных давлении, температуре и числах молей остальных компонентов:
этого компонента раствора при постоянных давлении, температуре и числах молей остальных компонентов:
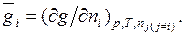 (6.5)
(6.5)
Соблюдение условий, требуемых этим определением, может быть достигнуто, если, например, к весьма большому объему раствора данной концентрации при постоянных  и Т добавить 1 моль какого-либо компонента. В этом случае концентрация раствора практически не изменится и соответствующее изменение свойства раствора будет парциальной молярной величиной добавленного компонента.
и Т добавить 1 моль какого-либо компонента. В этом случае концентрация раствора практически не изменится и соответствующее изменение свойства раствора будет парциальной молярной величиной добавленного компонента.
Например, парциальный молярный объем определяется уравнением
 (6.6)
(6.6)
Если раствор образуется из компонентов без изменения объема, то очевидно, что парциальный молярный объем равен его молярному объему, т. е.  где индекс «нуль» означает, что вещество находится в чистом состоянии. В отличие от молярного объема парциальный молярный объем может быть отрицательной величиной, например, если вследствие молекулярного взаимодействия при добавлении компонента к раствору происходит уменьшение объема. Если при образовании раствора из компонентов соблюдается аддитивность, то, например, для бинарного раствора, состоящего из n1 молей первого компонента и n2 молей второго:
где индекс «нуль» означает, что вещество находится в чистом состоянии. В отличие от молярного объема парциальный молярный объем может быть отрицательной величиной, например, если вследствие молекулярного взаимодействия при добавлении компонента к раствору происходит уменьшение объема. Если при образовании раствора из компонентов соблюдается аддитивность, то, например, для бинарного раствора, состоящего из n1 молей первого компонента и n2 молей второго:
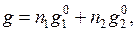 (6.7)
(6.7)
где 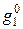 и
и 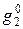 – молярные доли чистых веществ.
– молярные доли чистых веществ.
Очевидно, в этом случае при образовании раствора 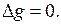
Если, например, при образовании раствора энтальпия аддитивна, то 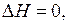 и, следовательно, раствор образуется без теплового эффекта. Если же энтальпия исходных веществ больше энтальпии раствора, то при образовании раствора происходит выделение тепла. В противоположном случае будет происходить поглощение тепла.
и, следовательно, раствор образуется без теплового эффекта. Если же энтальпия исходных веществ больше энтальпии раствора, то при образовании раствора происходит выделение тепла. В противоположном случае будет происходить поглощение тепла.
Среди парциальных молярных величин особое значение имеет парциальная молярная свободная энергия
 (6.8)
(6.8)
которая называется также часто химическим потенциалом и обозначается 
Химический потенциал наряду с температурой и давлением является интенсивной величиной. Таким образом, равенство температур давлений и химических потенциалов всех компонентов в различных частях системы выражает условия термического, механического и химического равновесий (см.раздел 2.12).
Величина 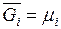 отражает тенденцию вещества покинуть данную фазу и является мерой его рассеиваемости. Рассмотрим две соприкасающиеся фазы – раствор и пар над ним. В каждой из этих фаз присутствует данный компонент i. При равновесии
отражает тенденцию вещества покинуть данную фазу и является мерой его рассеиваемости. Рассмотрим две соприкасающиеся фазы – раствор и пар над ним. В каждой из этих фаз присутствует данный компонент i. При равновесии
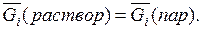 (6.9)
(6.9)
Если бы, например, химический потенциал вещества в растворе был больше, чем в газовой фазе, то происходило бы испарение этого вещества, при котором 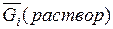 уменьшается, а
уменьшается, а 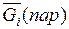 увеличивается, пока не установится равновесие. В обратном случае происходил бы переход компонента i из пара в раствор.
увеличивается, пока не установится равновесие. В обратном случае происходил бы переход компонента i из пара в раствор.
Парциальные молярные величины характеризуют свойства растворов. Они играют такую же роль в термодинамических расчетах равновесий в растворах, как соответствующие функции (U, H, F, G, S и т. д.) при расчетах, относящихся к реакциям между чистыми веществами. В связи с этим целесообразно составление таблиц парциальных молярных величин. Чтобы определить парциальную молярную величину данного компонента, необходимо найти зависимость соответствующего экстенсивного свойства от состава раствора при постоянных р общ, T и числах молей остальных компонентов и произвести дифференцирование по числу молей этого компонента. Для бинарных растворов такое определение обычно производится графически при помощи метода отрезков. Для этого вычисляют свойство одного моля раствора.
Молем раствора называется такое его количество, при котором число молей каждого компонента равное его мольной доле. Например, один моль раствора углерода в жидком железе, в котором 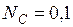 и
и 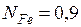 содержит 0,1 моля углерода и 0,9 моля железа. Так как атомная масса углерода равна 12, а железа 55,85, то масса одного моля такого раствора составит 12×0,1+55,85×0,9=51,465 г.
содержит 0,1 моля углерода и 0,9 моля железа. Так как атомная масса углерода равна 12, а железа 55,85, то масса одного моля такого раствора составит 12×0,1+55,85×0,9=51,465 г.
Свойство раствора g, относящееся к одному молю, обозначается индексом 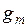 . Например, объем одного моля раствора обозначается
. Например, объем одного моля раствора обозначается 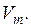
Графический метод определения парциальных молярных величин представлен на рис. 6.1. По оси абсцисс откладывают молярные доли первого и второго компонентов (N1 и N2). Точка О соответствует первому чистому компоненту; в этой точке N1 = 1 и N2 = 0. Точка О1 соответствует второму чистому компоненту; в этой точке N1 = 0 и N2 = 1. Каждая точка на прямой ОО1 соответствует раствору определенного состава.
Величина какого-либо свойства одного моля раствора 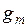 откладывается на оси ординат. Кривая АВ выражает зависимость свойства от состава раствора. Если при образовании раствора его свойство аддитивно складывается из свойств компонентов, то вместо кривой зависимость будет выражаться прямой линией. Отрезки ОА и О1В представляют собой соответственно мольные свойства чистых компонентов
откладывается на оси ординат. Кривая АВ выражает зависимость свойства от состава раствора. Если при образовании раствора его свойство аддитивно складывается из свойств компонентов, то вместо кривой зависимость будет выражаться прямой линией. Отрезки ОА и О1В представляют собой соответственно мольные свойства чистых компонентов 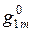 и
и 
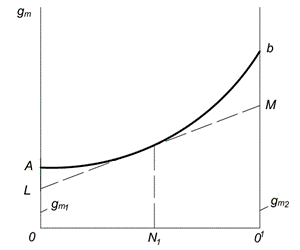
Рис. 6.1. Графический метод определения парциальных молярных величин
Для нахождения парциальных молярных величин компонентов в растворе данной концентрации, например 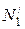 , следует провести касательную LM к кривой АВ в точке, соответствующей ординате, восстановленной из
, следует провести касательную LM к кривой АВ в точке, соответствующей ординате, восстановленной из 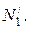 Отрезки, отсекаемые касательной на осях ординат OL и О1M, равны парциальным величинам
Отрезки, отсекаемые касательной на осях ординат OL и О1M, равны парциальным величинам 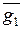 и
и 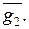
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 6939; Нарушение авторских прав?; Мы поможем в написании вашей работы!