
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартный водородный электрод
|
|
|
|
Электродные потенциалы и электродвижущие силы.
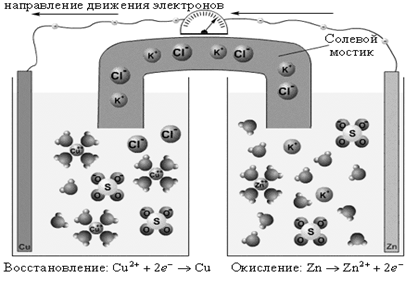
Если процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка (рис. 1) – представляет собой два сосуда, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода*)[1], представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).
Реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля–Якоби, схема которого
(–)Zn¦Zn2+||Cu2+¦Cu(+)
отражает современную систему обозначений для гальванических элементов. Слева записывается анод Zn¦Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu2+¦Cu – электрод с недостатком электронов, положительный полюс (+). Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме, как правило, не изображают. В круглых скобках знаками плюс и минус обозначают полюсы электродов.
Рассмотрим системы металл–растворитель и металл–электролит. В этих гетерогенных системах в зависимости от природы металла и электролита возможен переход ионов металла в раствор или ионов металла из раствора на поверхность металла. Эти процессы определяются отношением энтальпии отрыва иона от кристаллической решетки металла (ΔHреш) и энтальпии сольватации этого иона Mn+∙solv (ΔHsolv).
В результате на фазовой границе металл–электролит устанавливается равновесие:

Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к раствору. Если малоактивный металл погружен в раствор соли с концентрацией больше равновесной, то происходит переход ионов из раствора на металл, заряженный положительно (рис. 2). В любом случае возникает двойной электрический слой, и появляется разность электрических потенциалов, или гальвани-потенциал. Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода.
|
| Рисунок 1. Гальванический элемент Даниэля–Якоби |
Абсолютное значение разности потенциалов на границе двух фаз разной природы «металл│электролит» измерить нельзя, однако можно измерить разность потенциалов двух различных электродов.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K
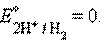

|
| Рисунок 2 Схема двойного электрического слоя (а) и (б); распределение заряда в объеме электролита (в). |
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с H+ по уравнению

Для гальванического элемента
(–)Pt, H2¦2H+||Mn+¦M(+),
в котором протекает окислительно-восстановительная реакция

запишем уравнение изотермы:
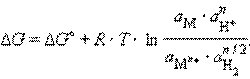
Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса:
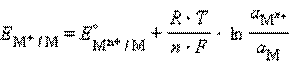 . (1)
. (1)
В этом уравнении ЕМ+/ М – ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея.
Уравнение (16.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода.
Отметив, что а Мn+ – активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
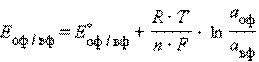
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста:
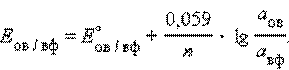
Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (aM) уравнение Нернста упрощается:
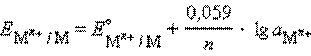
Потенциал электрода, как видно из этого уравнения, зависит от активности ионов а Мn+, которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E°.
Следует подчеркнуть, что:
1. Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная.
2. В дробном индексе при E и E° над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная.
3. Активности твердых веществ в уравнение Нернста не входят.
Значения некоторых стандартных окислительно-восстановительных потенциалов гальванических элементов, расположенных в порядке их возрастания, представлены в табл. 16.1.
Положительный окислительно-восстановительный потенциал электрода Cu2+│Cu (E° = +0,34 B) показывает, что в стандартных условиях водород окисляется ионами меди, медный электрод по отношению к водороду является катодом, электроны по внешней цепи переходят от водорода к меди:
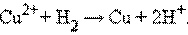
Отрицательный потенциал Zn2+│Zn (E° = –0,76 B) означает, что в стандартных условиях цинковый электрод может быть только анодом, его окислительные функции по отношению к водородному электроду 2H+│H2 отрицательные. Цинк здесь восстанавливает катионы водорода, электроны во внешней цепи перетекают от цинка к водороду:
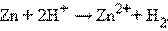
Суммируя эти реакции, получим
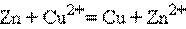 ,
,
то есть электрод с более положительным значением стандартного электродного потенциала является окислителем по отношению к электроду с менее положительным значением E°.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 309; Нарушение авторских прав?; Мы поможем в написании вашей работы!