
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроды первого рода
|
|
|
|
Таблица 1
Стандартные окислительно-восстановительные потенциалы window.top.document.title = "7.2.1. Стандартные окислительно-восстановительные потенциалы";
|
Классификация электродов window.top.document.title = "7.3. Классификация электродов";
Многочисленные ХИТ могут быть составлены из двух электродов (полуэлементов, электродных пар). По типу потенциалопределяющей реакции (окислительно-восстановительного электродного процесса) электроды делят на электроды первого рода, второго рода (электроды с электрохимической реакцией) и ионоселективные (без электрохимической реакции).
К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов.
Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы.
а) Металлический электрод – металл, погруженный в раствор своей соли M|Mn+, например, цинковый и медный электроды:

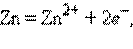

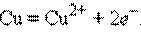
Металлический электрод обратим по отношению к катиону. Его электродный потенциал определяется по формуле:
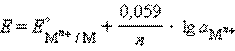
б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (H2, Cl2 и др.), адсорбированный на химически инертном проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие. Для хлорного и водородного электродов это равновесие можно представить уравнениями:
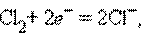

Соответствующие им уравнения Нернста имеют вид:
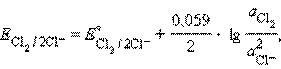

Очевидно, что их электродный потенциал зависит от давления и активности (концентрации) ионов в растворе.
2. Редокс-электроды состоят из электрохимически инертного проводника (платины, графита и т. д.), погруженного в раствор, в котором находятся окисленная и восстановленная формы потенциалопределяющего вещества. Такой инертный проводник способствует передаче электронов от восстановителя к окислителю через внешнюю цепь. Примерами таких электродов могут служить редокс-электроды с ионами в различных степенях окисления: (Pt)Sn4+, Sn2+, (Pt)Fe3+, Fe2+.
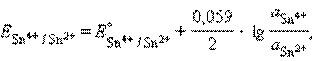

|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 279; Нарушение авторских прав?; Мы поможем в написании вашей работы!