
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Локальное равновесие
|
|
|
|
Слабо неравновесная линейная термодинамика
Линейная термодинамика описывает стабильное, предсказуемое поведение систем, стремящихся к минимальному уровню активности, совместимому с поступающими в них потоками. Линейная термодинамика допускает описание систем с помощью некоторых потенциалов, например, с помощью производства энтропии. Это означает, что и при эволюции к равновесному состоянию, и при эволюции к стационарному состоянию система «забывает» начальные условия. Каковы бы ни были начальные условия, система рано или поздно перейдёт в состояние, определяемое граничными условиями. В результате реакция такой системы на любое изменение граничных условий становится предсказуемой.
Мир, в котором мы живём, не является термодинамически равновесным. Однако, термодинамика равновесных состояний важна и практически полезна, так как большинство систем находится в состоянии локального термодинамического равновесия
Почти во всех макросистемах выполняется предположение о том, что равновесные термодинамические соотношения справедливы для термодинамических переменных, определённых в элементарном объёме dV (dV – физически бесконечно малая величина, которой называют конечную, но относительно малую часть целого). Если плотность числа частиц определена для объёма dV, то в данном объёме она должна быть почти однородной. Насколько малым может быть этот объём? Для идеального газа при Р= 1 атм и Т= 298 К при относительном числе флуктуаций частиц  объём
объём 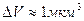 . Следовательно, имеет смысл определять молярную плотность для элементарного микрометрового объёма. Первое и второе начала термодинамики являются локальными законами [4]. Нелокальные законы сохранения энергии и производства энтропии недопустимы из-за относительности одновременности. Если в двух пространственно разнесённых системах происходит изменение энергии dU1 и dU2 одновременно и в одной из систем отсчёта выполняется закон сохранения энергии dU1 + dU2 =0, то в другой системе отсчёта, которая движется по отношению к первой, эти два изменения энергии уже происходят неодновременно, а в период времени между одним изменением энергии и другим закон сохранения энергии нарушится. Подобные выводы справедливы и для производства энтропии.
. Следовательно, имеет смысл определять молярную плотность для элементарного микрометрового объёма. Первое и второе начала термодинамики являются локальными законами [4]. Нелокальные законы сохранения энергии и производства энтропии недопустимы из-за относительности одновременности. Если в двух пространственно разнесённых системах происходит изменение энергии dU1 и dU2 одновременно и в одной из систем отсчёта выполняется закон сохранения энергии dU1 + dU2 =0, то в другой системе отсчёта, которая движется по отношению к первой, эти два изменения энергии уже происходят неодновременно, а в период времени между одним изменением энергии и другим закон сохранения энергии нарушится. Подобные выводы справедливы и для производства энтропии.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 262; Нарушение авторских прав?; Мы поможем в написании вашей работы!