
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ВОПРОС 2. Кинетика массопередачи
|
|
|
|
Массопередача — процесс перехода вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия.
В массообмене участвуют как минимум три вещества: распределяющее вещество (или вещества), составляющее первую фазу; распределяющее вещество (или вещества), составляющее вторую фазу; распределяемое вещество (или вещества), которое переходит из одной фазы в другую.
Обозначим первую фазу G, вторую — L, а распределяемое вещество — М. Все массообменные процессы обратимы, поэтому распределяемое вещество может переходить из фазы G в фазу L и наоборот в зависимости от концентрации вещества в фазах.
Пусть распределяемое вещество находится первоначально только в фазе G и имеет концентрацию Y. В фазе L в начальный момент распределяемое вещество отсутствует, т. е. концентрация его в этой фазе Х= 0.
Если распределяющие фазы привести в соприкосновение друг с другом, начинается переход распределяемого вещества из фазы G в фазу L и с появлением вещества М в фазе L начинается обратный переход его из фазы L в фазу G. До некоторого момента времени число частиц распределяемого вещества М, переходящих в единицу времени из фазы G в фазу L, больше, чем число частиц, переходящих из фазы L в фазу G. Однако конечным результатом является переход вещества М из фазы G в фазу L. По истечении определенного времени скорости прямого и обратного перехода вещества М в фазах G и L становятся одинаковыми. Такое состояние системы называется равновесным. При равновесии устанавливается строго определенная зависимость между концентрациями распределяемого вещества в фазах. Такие концентрации называют равновесными.

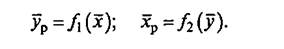 (1)
(1)
Эти зависимости определяются экспериментально и называются равновесными зависимостями.
Равновесные зависимости изображаются графически кривой или в частном случае прямой линией. На рис. 1 показана зависимость равновесной концентрации ур компонента в газовой фазе G от его концентрации хр в жидкой фазе L при постоянных давлении и температуре.
Соотношение концентраций компонента в фазах в условиях
равновесия 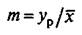 называется коэффициентом распределения.
называется коэффициентом распределения.
Коэффициент распределения геометрически выражается тангенсом угла наклона линии равновесия. В случае кривой линии равновесия коэффициент распределения является переменной величиной.
Конкретный вид законов равновесия применительно к различным процессам массопередачи будет рассмотрен в соответствующих главах.
Равновесные зависимости позволяют определить не только направление процесса, но и скорость перехода распределяемого вещества из одной фазы в другую.
Разность между фактической и равновесной концентрациями, характеризующая степень недостижения равновесия, является движущей силой массообменных процессов.
Основные уравнения массопередачи могут быть получены из общего уравнения кинетики. Согласно этому уравнению скорость массообменных процессов прямо пропорциональна движущей силе процесса и обратно пропорциональна диффузионному (массообменному) сопротивлению.
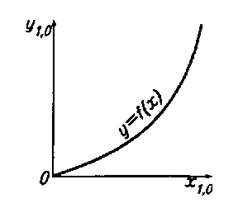
Рис.1. Диаграмма равновесия при р = const и t = const
Обозначив величину, обратную диффузионному сопротивлению, К= 1/R (где R — диффузионное, или массообменное, сопротивление), запишем
 (2)
(2)

Распределяемое вещество всегда переходит из фазы, где его содержание выше равновесного, в фазу, в которой концентрация этого вещества ниже равновесной.
Движущая сила массообменных процессов определяется степенью отклонения от равновесия – разностью между рабочей и равновесной или равновесной и рабочей концентрацией.
Нетрудно видеть, что dM/Fdτ является скоростью массопередачи, отнесенной к единице контакта фаз. Если dM отнесено к единице времени, то
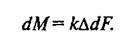 (3)
(3)
При к = const для всей поверхности массообмена
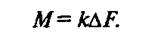 (4)
(4)
Уравнения (3) и (4) называются основными уравнениями массопередачи. Согласно этим уравнениям количество вещества, перенесенного из ядра одной фазы в ядро другой фазы, пропорционально разности его концентраций в ядрах фаз, площади поверхности фазового контакта и продолжительности процесса.
Коэффициент массопередачи показывает, какое количество вещества переходит из одной фазы в другую в единицу времени через единицу поверхности фазового контакта при движущей силе, равной единице.
Коэффициенты массопередачи в зависимости от единиц, в которых выражены движущая сила и количество распределяемого вещества, могут выражаться в м/с, кг/(ед. дв. силы • м2 • с), кмоль/(ед. дв. силы • м2 • с).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 920; Нарушение авторских прав?; Мы поможем в написании вашей работы!