
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия и определения. 24.1 Основные понятия и определения
|
|
|
|
ЛЕКЦИЯ 24. ОБЩАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ.
24.1 Основные понятия и определения. Способы выражения состава растворов.
24.2. Теория растворения вещества.
24.3. Термодинамика растворения.
В металлургии редко приходится иметь дело с чистыми веществами. Даже металлы, получаемые в особо чистом состоянии, например кремний или германий для полупроводниковых устройств, содержат примеси и по существу являются растворами. Вообще, как правило, участвующие в металлургических превращениях вещества и в твердом и в жидком состояниях являются растворами.
Приведем некоторые примеры. Расплавленные чугун или сталь представляют собой растворы углерода, кремния и других элементов в жидком железе. Сталь в твердом состоянии представляет собой раствор углерода в железе, в котором в виде отдельных более или менее крупных включений присутствуют химические соединения - карбиды, нитриды, оксиды и т.п. Нержавеющие стали - это твердые растворы на основе железа, хрома и никеля. Вообще металлические сплавы либо являются твердыми растворами, либо содержат их наряду с другими составляющими, например химическими соединениями.
Жидкие шлаки в доменных и сталеплавильных печах являются растворами оксидов, содержащими и другие соединения - силикаты, фосфаты, сульфиды. Поэтому практически все металлургические процессы, начиная от выплавки металла из руд и его рафинирования от вредных примесей и кончая химической или химико-термической обработкой готовой стали, происходят с участием жидких или твердых растворов. Особое место занимают водные растворы, без которых была бы невозможна органическая жизнь. В металлургии водные растворы используют для извлечения металлов из руд, при получении металлов электролизом и при производстве гальванических покрытий.
Свойства веществ в растворах существенно отличаются от их свойств в чистом состоянии, что оказывает иногда решающее влияние на направление реакций. Поэтому теория растворов занимает одно из наиболее важных мест при рассмотрении металлургических процессов и свойств металлов и сплавов в твердом состоянии.
Следуя правилу фаз, раствором называют гомогенную часть многокомпонентной системы, состав которой может непрерывно и произвольно изменяться. Относительное содержание компонентов в растворе может быть любым и ограничивается лишь их взаимной растворимостью.
Один из компонентов раствора называют растворителем, а остальные - растворенными веществами. Обычно растворителем принято считать жидкость, если раствор получен смешением последней с газами или твердыми телами. Но если компоненты раствора перед смешением были в одинаковых агрегатных состояниях, то растворителем считается тот компонент, количество которого в системе преобладает. Например, воздух считается раствором кислорода, гелия, углекислого газа и др. в азоте, т.е. азот – растворитель, а все остальные компоненты - растворенные вещества. Система, состоящая из аммиака, поваренной соли и воды, считается раствором первых в воде.
Растворы в природе могут быть твердыми, жидкими и газообразными. Наиболее распростра-
нены жидкие и газообразные растворы. Остановимся на свойствах жидких растворов, способных к испарению.
24.1.2. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРО В.
Свойства растворов обычно рассматривают в их зависимости от давления, температуры и состава системы. Состав - важнейшая характеристика раствора - может быть выражен в относительных или специальных единицах. К первым относятся доли: массовые (масс), объемные (об.) и молярные (мол.). С ними мы уже ознакомились при изучении газовых смесей (см. выражения 1.17- 1.19.)
К специальным единицам состава растворов относятся молярность, моляльность, нормальность и т.п.
Молярность М - единица молярной концентрации (С или См) раствора; определяется числом моль вещества, растворенных в 1 л (1 10 -3 м3) раствора (сравните с газами, см. вопрос 3.3).
1М = 1 моль/л = 1 10 3 моль/м3.
Отсюда, согласно(1.20), следует
СМ = 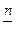

Vр-ра л (5.1)
Моляльность Мл - единица моляльной концентрации (m или Ст) раствора; определяется числом моль вещества, растворенных в 1 кг растворителя
1 Мл = 1 моль/кг
Если в g кт растворителя растворено а кг вещества i, молярная масса которого Мi. кг/моль, то моляльная концентрация раствора рассчитывается по формуле -
Cm = 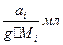 (5.2)
(5.2)
Если масса вещества выражена в граммах, а молярная масса - в г/моль, то формула будет иметь, естественно, такое же выражение. Если же и масса растворителя будет выражена в граммах, то формула примет вид –
Cm =  (5.2а)
(5.2а)
Нормальность Н - единица эквивалентной концентрации (или эквивалентной молярной концентрации) N (или CN) раствора; определяется числом моль эквивалентов (пЭКВ) вещества; растворенных в 1л (1۰10-3 м3) раствора -
1н = 1 моль экв./л
Если в V л раствора растворено п ЭКВ, вещества, то эквивалентная концентрация рассчитывается по формуле -
CN = п i;экв / V р-ра 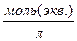 (5.3)
(5.3)
Количества вещества эквивалента определяется по той же формуле, что и обычные количества вещества, но с использованием молярной массы эквивалента МЭКВ. или
nЭКВ, = m/МЭКВ, или n (1/z(x)) = m(x) / M (1/z(x))
где z - число эквивалентности - переменная величина, зависящая от состава вещества или от конкретной химической реакции, в которую вступает данное вещество X. Число эквивалентности Z связано с фактором эквивалентности вещества X соотношением:
fЭКВ. (Х)= 1/z
Фактор эквивалентности f ЭКВ, (X) - число, показывающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции (следует помнить, что эквивалент - это условная, или реальная, частица вещества X (часть молекулы, иона и др.), которая в кислотно-основной реакции равноценна по химическому действию одному иону водорода или в окислительно-восстановительной реакции одному электрону.
Молярная масса эквивалента вещества X - масса вещества количеством один моль эквивалентов, равная произведению фактора эквивалентности на молярную массу вещества:
М (f экв (х) X) = f экв (х)۰М (X) или М ( =
= М (X)
М (X)
Число эквивалентности для атома элемента А в соединении соответствует его степени окисления (с.о.)
Z = | с.о.!, тогда fЭКВ. = 1/с.о.
Число эквивалентности кислоты соответствует ее основности в
данной реакции, т.е. числу ионов водорода, замещенных на ионы металла
Число эквивалентности основания соответствует его кислотности в данной реакции, т.е. числу гидроксид-ионов, замещенных на ионы кислотных остатков; тогда Число эквивалентности вещества X, присутствующего в окислительно- восстановительной реакции, соответствует числу отданных или принятых им электронов.
Z = пё, тогда fэкв (х) = .
.
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 л раствора вещества 1 с нормальностью N1 реагирует с V2 л раствора вещества 2 с нормальностью N2. Это означает, что в реакцию вступило N1V1 моль эквивалентов вещества 1 и N2 V2 моль эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно
N1V1 = N2 V2 или V1: V2 = N2: N1
Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
На основании этой зависимости можно не только вычислить требуемые для проведения реакций объемы растворов, но и обратно, по объемам затраченных на реакцию растворов находить их концентрации.
Единицы состава раствора, выраженные в мол., масс, долях и моляльностях, не зависят от температуры системы. Эта особенность позволяет использовать их в экспериментах с изменяющейся температурой.
Для изучения отдельных свойств растворов в изолированном, «чистом» виде, вводится понятие идеальный раствор, Идеальный раствор – это такая гомогенная многокомпонентная система, в которой силы взаимодействия между любыми частицами одинаковы.
Этому условию соответствуют идеальные газы, смеси изотопов одного и того же элемента и смеси оптических изомеров органических соединений. Близки к идеальным растворам смеси углеводородов одного и того же гомологического ряда и сильно разбавленные растворы.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 545; Нарушение авторских прав?; Мы поможем в написании вашей работы!