
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория растворения веществ
|
|
|
|
По структуре раствор, занимают промежуточное положение между механическими смесями и химическими соединениями. С механическими смесями их роднят переменность состава и непрерывная, «плавная» зависимость их свойств от состава; а с химическими соединениями - однородность состава по всей фазе и наличие теплового эффекта при образовании. В соответствии с этим, первое время существовали две противоборствующие теории: «физическая» и «химическая», каждая из которых отстаивала свои взгляды на строение растворов.
Современные представления о строении растворов основываются на солъватной теории, выдвинутой Менделеевым и развитой его последователями. Согласно этой теории, в системе при растворении одновременно происходят два процесса: распределение растворяемого вещества в объеме растворителя (физический процесс) и образование
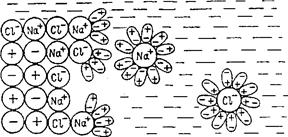
Рис. 5.1 Гидратация ионов Na и СГ при растворении NaCI
из молекул растворителя и растворяемого вещества нестойких соединений переменного состава - сольватов (химический процесс).
Менделеев, изучавший водные растворы, назвал эти соединения гидратами. Он установил, что соединение молекул или ионов растворяемого вещества с молекулами растворителя осуществляется главным образом за счет образования водородной связи или вследствие электростатического взаимодействия полярных молекул веществ. Особенно склонны к сольватации ионы.
Сольватацию можно рассмотреть на примере растворения кристалла поваренной соли в воде (рис. 5.1) Диполи воды ориентируются вокруг отрицательных ионов хлора своим положительным полюсом, а вокруг положительных ионов натрия - отрицательным, т.е. происходит гидратация ионов. В результате этого процесса связь между поверхностно расположенными ионами в кристалле хлорида натрия ослабляется. Ионы натрия и хлора отрываются от кристалла, а молекулы воды образуют вокруг них так называемые гидратные оболочки. Отделившиеся гидратированные ионы под влиянием теплового движения перемещаются, равномерно распределяясь между молекулами растворителя.
Под сольватацией понимают всю совокупность взаимодействий, осуществлящихся в растворе, которые в зависимости от природы растворителя и растворенного вещества могут
иметь различную природу и проявляться по-разному. Например, сольватация молекул иода молекулами тетрахлорида углерода, молекул фосфора или серы молекулами сероуглерода осуществляется исключительно за счет слабого ван-дер-ваальсовского взаимодействия, но все же энергия сольватации оказывается больше, чем энергия взаимодействия частиц в молекулярных кристаллах. Как правило, из таких молекулярных растворов растворитель легко удаляется, а растворенное вещество остается в химически неизменном виде. При испарении растворителя из перечисленных растворов можно получить кристаллы иода, фосфора, серы. Это пример слабых сольватационных взаимодействий.
Примером сильного сольватационного взаимодействия может служить взаимодействие воды с ионом Fe 3+. При растворении в воде безводного трихлорида железа молекулы Fe2CI6, из которых образован кристалл, настолько энергично взаимодействуют с молекулами воды, что не только распадаются на ионы, но и ион Fe3+ образует очень прочную комплексную частицу [Fe(H20)6]3+ . Если теперь удалять растворитель, то из раствора кристаллизуется не безводный хлорид, а так называемый кристаллогидрат - соединение с водой - FeCI3 * 6Н20, или, точнее, аквакомплекс [Fe(H20)6]CI3. Удалить из него воду и получить таким образом безводный FeCI3 невозможно. Например, при нагревании кристаллогидрата через ряд сложных форм происходит не только удаление воды, но и полный распад соединения с образованием оксида и газообразного HCI:
2[Fe(H20)6 ]CI3 = Fe203 + 6HCI + 9Н20.
Между этими двумя крайними случаями - сохранением молекул в растворе и их распадом - существует великое множество промежуточных. Например, из раствора иода в спирте выделяются кристаллы сольвата. В этом случае энергия взаимодействия иода с растворителем так велика, что продукт взаимодействия может быть выделен как индивидуальное вещество. Но соединение иода с бензолом настолько непрочно, что существует только в растворе, а из раствора кристаллизуется чистый иод. Трихлорид железа из раствора в РОС13 кристаллизуется в виде FeCI3 е РОС13 - кристаллосольвата или аддукта, а из раствора в дихлорэтане C2H4CI2 кристаллизуется чистый FeCI3.
Таким образом, растворимость вещества определяется тем, насколько различаются энергии межмолекулярного взаимодействия в чистом растворяемом веществе и в чистом растворителе. Если значения энергии взаимодействия близки, то растворимость, как правило, велика, если же они различаются сильно, то мала. Отсюда следует правило, установленное еще алхимиками: подобное растворяется в подобном.
Способностью сольватироваться (гидратироваться) при растворении обладают не только
кристаллические вещества, но также газообразные и жидкие.
24.3. ТЕРМОДИНАМИКА РАСТВОРЕНИЯ.
Для выявления термодинамических особенностей растворов воспользуемся сольватной теорией и аддитивностью функций состояния системы. На основании этого процесс растворения можно представить состоящим из двух последовательных стадий: распределения растворяемого вещества по объему растворителя и образования сольватов. Первая стадия тождественна фазовому переходу: плавлению - при растворении кристаллических тел, конденсации - при растворении газов; вторая - химическому процессу.
На основании этого, согласно закону Гесса, теплоту растворения можно оценить как сумму
энтальпий указанных стадий (см. вопрос 11.5).
∆НФ = ∆НФ + ∆НС
Что касается энтропии, то необходимо иметь в виду, что при образовании растворов наряду с вышеупомянутыми физическими и химическими процессами происходит ещё и взаимное смешение веществ. Тогда, исходя из свойств энтропии (см. лекц.13, пункт 7), при образовании раствора, состоящего из k компонентов, имеем
∆SР = ∆БФ + ∆SC + ∆S CMЕШЕНИЯ
Сольватация, как правило, сопровождается убылью энтальпии (АНС < 0). Энтропия при этом вследствие упорядочения микроструктуры системы также уменьшается (∆SC< 0).
Плавление тел сопровождается увеличением их энергии и возрастанием беспорядка в их микроструктуре. В результате этого и энтальпия, и энтропия системы при плавлении увеличиваются (∆Н ПЛ > 0 и. ∆S nn. >0).
Конденсация газов сопровождается убылью энергии системы, а порядок в ее микроструктуре при этом возрастает. В результате этого и энтальпия, и энтропия системы при конденсации уменьшаются
(∆ Н конд. < 0 и ∆S конд. < 0).
Смешение не отражается на энтальпии системы, а ее энтропия при этом в любом случае увеличивается (∆SCM > 0).
Из вышеизложенного следует, что суммарные изменения энтальпии и энтропии системы при образовании растворов (энтальпия растворения ∆Нр и энтропия растворения (∆Sp.) зависят как от абсолютного значения, так и от знака изменения соответствующих функций на отдельных стадиях процесса.
Если | ∆ Н с | > | ∆ Н пл.|, то растворение солей экзотермично, если же
| ∆ Н с | < | ∆ Н пл.|, то – эндотермично, Обычно процесс растворения кристаллогидратов эндотермичен, а безводных солей - экзотермичен.
В случае растворения газов оба слагаемые (∆ Н С. и ∆Нконд.) отрицательны. Следовательно, растворение газов в любом случае сопровождается убылью энергии, т.е.- это экзотермический процесс.
Вопрос об энтропии растворения значительно сложнее, так как она состоит из трех переменных, малодоступных для измерения. Результаты могут оказаться самыми разнообразными. Однако в любом случае при растворении происходит убыль гиббсовой энергии системы: ∆GP = ∆HP-T∆SP<0
Из приведенного выражения следует, что абсолютное значение ∆ GP с повышением Т возрастает, если ∆S Р > 0 и убывает - при ∆ S Р< 0. Это позволяет утверждать, что энтропия растворения - одна из основных характеристик процесса образования растворов.
Растворение, как и любой другой термодинамический процесс, протекает до установления в системе равновесия с избытком растворенного вещества (осадком - в случае растворения кристаллических тел, газом над раствором - в случае растворения газов и т. п.). Количество растворенного вещества, необходимое для получения насыщенного раствора в заданном количестве растворителя определяет растворимость этого вещества. Растворимость Si выражают, как правило, в г безводного вещества i, приходящихся на 100 г чистого растворителя. Для пересчета растворимости S; в массовые доли следует пользоваться формулой:
gi = 100 Si / (100 + Si), %. (В настоящее время растворимость часто указывают на 1000 г растворителя).
Растворимость, будучи характеристикой равновесного состояния системы, зависит от природы растворителя и растворенного вещества, а также от температуры, давления и присутствия других компонентов (примесей). Зависимость растворимости от температуры и давления согласуется с принципом Ле - Шателье: если растворение экзотермично, то повышение температуры уменьшает растворимость; если растворение сопровождается уменьшением объема системы, то при повышении давления растворимость увеличивается, и наоборот. Из этого следует, что растворимость газов в жидкостях увеличивается с понижением температуры и повышением давления, а растворимость кристаллических тел при повышении температуры увеличивается, если ∆Н Р > 0, уменьшается - если ∆Н Р < 0 и практически не зависит от давления. Данные о растворимости веществ приведены в справочниках.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 4842; Нарушение авторских прав?; Мы поможем в написании вашей работы!