
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа диссоциации
|
|
|
|
Степень диссоциации. Сила электролитов.
Если бы электролиты полностью диссоциировали на ионы, то осмотическое давление (и другие пропорциональные ему величины) всегда было бы в целое число раз больше значений, наблюдаемых в растворах неэлектролитов. Но еще Вант-Гофф установил, что коэффициент i выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам.
Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует в растворе на ионы, и ввел понятие степени диссоциации.
Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
Позже было установлено, что электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически нацело. Понятие степени диссоциации к ним по существу не применимо, а отклонение изотонического коэффициента i от целочисленных значений объясняется другими причинами.
Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
К сильным электролитам принадлежат почти все соли; из важнейших кислот и оснований к ним относятся HNO3, HCIO4, HCI, HBr, HI, KOH, NaOH, Ba (OH)2 и Ca (OH)2.
К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат H2CO3, H2S, HCN, H2SiO3 и NH4OH.
Степень диссоциации принято обозначать греческой буквой а и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора
СН3СООН а = 0,013 (или 1,3%), а для 0,1 н. раствора НСN а = 10-4 (или 0,01%).
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты
СН3 СООН ↔ Н+ + СН3 СОО-
константа равновесия имеет вид
К = 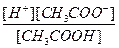
Здесь в числителе дроби стоят концентрации ионов – продуктов диссоциации, а в знаменателе – концентрация недиссоциированных молекул.
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени:
Н2СО3 ↔ Н+ + НСО3-
НСО3- ↔ Н+ + НСО32-
Первое равновесие – диссоциация по первой ступени – характеризуется константой диссоциации, обозначается К1
К 1 = 
а второе – диссоциация по второй ступени – константой диссоциации К2:
К2 =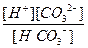
Суммарному равновесию
Н2СО3 ↔ 2Н+ +СО32-
отвечает суммарная константа диссоциации К:
К =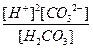
Величины К, К1 и К2 связаны друг с другом соотношением:
К = К1 К2
26.4. Сильные электролиты.
В водных растворах сильные электролиты обычно полностью диссоциированы. Поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. И если в растворах слабых электролитов концентрация ионов мала, расстояния между ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. Например, в насыщенном растворе хлорида натрия среднее расстояние между ионами всего только в 2 раза больше, чем в кристаллах NаСI. При этом силы межионного притяжения и отталкивания довольно велики. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы».
В отсутствие внешнего электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион, взаимно уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера – в противоположную, вследствие чего направленное перемещение иона замедляется, а следовательно, уменьшается число ионов, проходящих через раствор за единицу времени, т.е. сила тока. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы на электропроводность раствора. Значения степени диссоциации хлорида калия, вычисленные при 180 С по электропроводности его растворов, показывают, что с ростом концентрации α падает:
концентрация KCl, н 0.01 0.1 1 2
α, % 94,286,2 75, 671,2
Однако падение степени диссоциации объясняется не образованием молекул, а увеличением тормозящего действия ионной атмосферы. В связи с этим, определяемое по электропроводности (или другими методами) значение степени диссоциации сильных электролитов называется кажущейся степенью диссоциации.
Аналогично силы межионного притяжения и отталкивания влияют и на величину осмотического давления, которая, несмотря на полную диссоциацию, всё же меньше, чем следовало бы ожидать при удвоенном, утроенном и большем числе частиц. Следовательно, все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита.
Для оценки состояния ионов в растворе пользуются величиной, называемой активностью.
Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях. Активность иона а равна его концентрации С, умноженной на коэффициент активности f:
а = f: С (5.10)
Коэффициенты активности различных ионов различны. Кроме того, они изменяются при изменении условий, в частности при изменении концентрации раствора. В концентрированных растворах коэффициент активности обычно меньше единицы, а с разбавлением раствора он приближается к единице.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2416; Нарушение авторских прав?; Мы поможем в написании вашей работы!